- Как приготовить временный препарат для микроскопа
- Приготовление препарата для микроскопа
- Приготовления препарата «раздавленная капля»
- Приготовление препарата «висячая капля»
- Приготовление препарата «отпечаток»
- Приготовление препарата «отпечаток», иной способ
- Приготовление препарата «фиксированный мазок»
- Примеры микропрепаратов для микроскопа
- Приготовление препаратов для микроскопирования
Как приготовить временный препарат для микроскопа
Вы приобрели микроскоп с мощным увеличением, что делать дальше?!
Возникает вопрос, что же можно в него увидеть, и где это взять?!
Есть два хороших варианта.
Первый, более простой, но не менее интересный, приобрести сразу набор готовых микропрепаратов.
http://vk.com/album-60198342_181686705
Но, даже после этого, спустя какое-то время, захочется изготовить что-то самим. И вот тут как раз появляется альтернатива.
Второй вариант, про что и пойдет речь в данной статье. Как приготовить самим микропрепарат.
Для начала, потребуется наличие набора чистых предметных и покровных стекол, которые так же можно приобрести. http://vk.com/photo-60198342_313580474
Итак, как же приготовить микропрепарат в домашних условиях?
В первую очередь, нужно разобраться, какие они бывают.
А бывают они временные и постоянные.
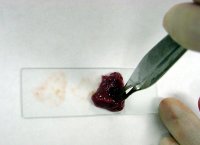
Для приготовления временного препарата, необходимо на предметное стекло поместить сначала каплю воды (глицерина, раствора, красителя, реактива), а потом в эту каплю поместить уже сам микрообъект. После этого капля накрывается покровным стеклом. Полученный микропрепарат готов к использованию. Такой временный препарат можно использовать повторно в течение нескольких последующих дней при правильном хранении.
Постоянные микропрепараты в отличие от временных могут храниться годами, для этого микрообъекты помещаются в специальный бальзам (целлоидин).
Микропрепараты можно разделить на сухие и влажные. Выше была описана методика приготовления влажного препарата, то есть препарата, в котором образец не может обходиться без воды, чтобы оставаться живым. Что касается сухих микропрепаратов, то для их приготовления не используется вода. На предметное стекло помещается очень тонкий срез образца, который накрывается покровным стеклом. После этого покровное стекло можно слегка придавить (только делайте это в резиновых перчатках, чтобы не оставлять следов).
Иногда при приготовлении микропрепаратов дополнительно используют специальный краситель, так как без окрашивания некоторые образцы очень трудно изучать под микроскопом. Обычно в качестве красителя используется раствор йода и йодида калия (также в ход может идти раствор «метиленового синего» или «кристаллического фиолетового»).
Рассмотрим пару примеров!
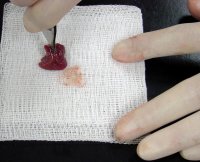
1. Возьмите предметное стекло и, держа его за боковые грани, положите на стол.
Положите в центр стекла объект исследования (тонкие волокна ваты).
В пипетку наберите немного воды из стаканчика и нанесите на препарат 1-2 капли.
Возьмите за боковые грани покровное стекло и положите его сверху на предметное стекло (см.рис.ниже).
Препарат готов. Положите его на предметный столик и рассмотрите под микроскопом.
2.Приготовление препарата чешуи кожицы лука. Данный пример, следуя инструкции из первого, попробуйте приготовить сами. При этом, обратите внимание на картинку. (см.рис.ниже).
Таким образом, мы можем рассматривать под микроскопом как готовые микропрепараты из набора, так и микропрепараты приготовленные вручную.
Источник
Приготовление препарата для микроскопа
В этой статье расскажу 3 способа приготовления препаратов для микроскопа. Эти способы — самые простые.
В начале статьи — так называемый словарик, а точнее пояснения, что такое тот или иной предмет.
Для изготовления микропрепаратов требуется специальный инструмент, красители, а также определенная аккуратность и сноровка. Очень важно строгое соблюдение всех необходимых условий – иначе микропрепарат может оказаться непригодным для исследований.
В продаже есть готовые наборы препаратов для исследований (что удобно для дома и школы) — например, 25 препаратов, или 38 слайдов от Левенгук. А также минералы и другие наборы.
Смотрите КАТАЛОГ микроскопов.
пояснения
Фиксированный препарат — в микробиологии часто готовят именно фиксированные препараты, так что следует знать, что это такое. Эти препараты рассматривают под микроскопом именно в окрашенном виде. Под словом «фиксация» имеется ввиду такая обработка живого объекта (который вы собираетесь рассмотреть), которая дает возможность быстро прервать жизненные процессы в том или ином объекте (поясню проще — убить), при этом сохранив тонкую структуру. В результате фиксации клетки прочно прикрепляются к стеклу и лучше прокрашиваются. Фиксация необходима в случае работы с патогенными микроорганизмами (в целях самобезопасности).
Патоген, патогенный микроорганизм — живой организм, паразит, вызывающей патологическое состояние (заболевания) иного живого организма.
Суспензия — смесь каких-либо веществ, где твёрдое вещество распределено в виде мельчайших частиц в жидком веществе в неосевшем состоянии.
Биологическая петля — тонкая металлическая палочка, на конце — тонкая металлическая петля. Используется для захватывания маленького количества той или иной суспензии микроорганизмов.
Вазелин — мазеобразная жидкость без запаха и вкуса. Смесь состоит из минерального масла и твёрдых парафинов (воскоподобная смесь).
Герметизация — обеспечение совершенной непроницаемости для разных газов и жидкостей поверхностей и мест соединения деталей.
Агар-агар — в микробиологии используется для изготовления плотных и полужидких питательных сред, то есть агаризованных сред.
Жидкость Карнуа — жидкость для фиксации.
Горелка — устройство, имеющее инжектор, который установлен в металлической трубке с отверстиями для поступления в эту трубку атмосферного воздуха, которая закреплена на подставке с боковым вводом для подачи в трубку газа, при этом отверстия выполнены на боковой поверхности трубки, на которой для изменения подачи воздуха в горелку, может быть установлена подвижная заслонка, изменяющая площадь проходного сечения этих отверстий.
Смесь Никифорова — смесь равных объемов этилового спирта и безводного серного эфира, применяется для фиксации мазков крови, мазков-отпечатков органов и каких либо тканей.
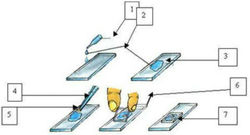
Приготовления препарата «раздавленная капля»
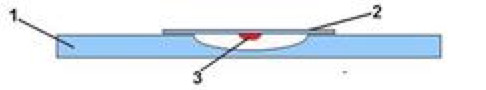
Приготовление препарата «висячая капля»
- Одну каплю суспензии микроорганизмов (заранее приготовленной) с помощью биологической петли аккуратно нанесите на чистое покровное стекло.
- Переверните покровное стекло с каплей суспензии так, чтобы капля свободно висела.
- Поместите перевёрнутое покровное стекло с каплей над лункой специального покровного стекла с углублением в центре.
- Капля не должна касаться краёв стекла и углубления (лунки), она должна свободно висеть на покровном стекле.
- Края углубления специального покровного стекла предварительно смазывают вазелином для герметизации камеры.
- Наслаждайтесь наблюдением за бактериями в микропрепарате!
Приготовление препарата «отпечаток»
Из агаризованной среды, на которой какие-либо микроорганизмы растут абсолютным сплошным газоном или же в виде отдельных колоний, аккуратно вырежете скальпелем не очень большой кубик.
Перенесите его на предметное стекло таким образом, чтобы поверхность кубика с микроорганизмами была обращена именно вверх.
Затем к газону микроорганизмов или к колонии приложите обычное покровное стекло (абсолютно чистое), аккуратно и не сильно, а слегка, надавите на него биологической петлей или пинцетом и тотчас снимите, стараясь не сдвинуть его в сторону.
Полученный препарат (покровное стекло с отпечатком) помещают именно отпечатком вниз в каплю обычной воды на чистое предметное стекло. Отпечаток также можно получить и на предметном стекле, если касаться поверхности колонии предметным стеклом.
Приготовление препарата «отпечаток», иной способ
Из агара в чашке Петри с засеянными на нем бактериями (бактериальным газоном) вырежьте блок.
Возьмите обезжиренное чистое стекло и приложите его к поверхности блока агара, засеянного бактериями. Получился первый отпечаток, Отпечатки делайте до тех пор, пока бактериальный слой на блоке не истощится, располагая их слева направо начиная с левой короткой грани стекла.
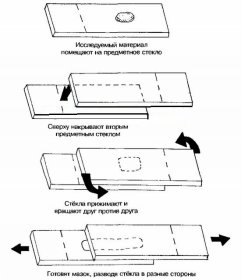
Приготовление препарата «фиксированный мазок»
Для того, чтобы приготовить этот препарат, требуется на обезжиренное предметное стекло нанести одну каплю воды.
В неё биологической петлей внесите исследуемый вами материал и распределите его так, чтобы получить тонкий и равномерный мазок диаметром примерно 1-1,5 сантиметра (только при таком распределении материала в мазке можно увидеть изолированные бактериальные клетки).
Если исследуемый материал содержится в жидкой среде, то петлей его непосредственно наносят на предметное стекло и готовят мазок. Мазки высушивают на воздухе или в струе теплого воздуха над пламенем горелки.
Для фиксации мазка предметное стекло (именно мазком вверх) очень аккуратно и медленно проводят 3 раза (в течение всего 3 секунд) через пламя горелки. Микроорганизмы, находящиеся в мазке, при фиксации погибают, плотно прикрепляясь к поверхности предметного стекла, и они не смываются при дальнейшей обработке препарата.
Внимание! Более долгое нагревание может вызвать деформацию структур клеток. Мазки крови, мазки-отпечатки органов и каких-либо тканей и (в некоторых случаях и мазки из культур), фиксируют погружением на 5-20 минут в метиловый синий или этиловый спирт, смесь Никифорова, также сулемовый спирт или иные фиксирующие жидкости.
Примеры микропрепаратов для микроскопа
Перечень микропрепаратов набора на 25 слайдов от WSBD World:
Loose Connective Tissue Рыхлая волокнистая соединительная ткань
Spinal Cord c.s. Поперечный срез спинного мозга
Motor Nerve Ending Нервные клеточные окончания (нейроны)
Stomach Mammal Sec. Срез ткани желудка млекопитающего
Kidney c.s. Поперечный срез почки
Artery & Vein c.s. Поперечный срез вены и артерии
Blood Vessel of Lung Срез кровеносного сосуда легкого
Blood Vessel of kidney Срез кровеносного сосуда почки
Tase Bud Вкусовой рецептор
Mouth Smear Мазок со слизистой полости рта
Human Sperm Smear Мазок человеческой спермы
Mitosis of Animal Cell Митоз клетки животного
Hydra thru Testis c.s. Семенник гидры
Hydra thru Ovary c.s. Яичник гидры
Hydra with Bud Гидра с отростком
Fern Prothalium wm Заросток папоротника
Zea Mays Seed l.s. Срез семян кукурузы
Spirogyra Спирогира
Lung Mammal Легкое млекопитающего
Colon Mammal Толстая кишка млекопитающего
Trachea Mammal Трахея млекопитающего
Pancreas Mammal Поджелудочная железа млекопитающего
Uterus Mammal Матка млекопитающего
Spleen Mammal Селезенка млекопитающего
Onion Root Tips Корневые кончики лука
Содержимое другого набора (38 штук) — Levenhuk N38 NG набор готовых микропрепаратов:
Ботаника и зоология:
Кожица лука
Зерновка ржи
Корневой чехлик
Ветка липы
Пыльник
Завязь
Камелия
Эпидермис листа герани
Конечность пчелы
Крыло пчелы
Циклоп
Вольвокс
Эвглена
Инфузория-туфелька
Дождевой червь (поперечный срез)
Ротовой аппарат комара
Аскарида
Дафнии
Биология и физиология:
Мутация дрозофилы (бескрылая форма)
Мутация дрозофилы (черное тело)
Дрозофила «норма»
Животная клетка
Растительная клетка
Плесень мукор
Дробление яйцеклетки
Митоз в корешке лука
Поперечно-полосатые мышцы
Сперматазоиды млекопитающего
Нерв (поперечный срез)
Рыхлая соединительная ткань
Яйцеклетка млекопитающего
Нервные клетки
Гиалиновый хрящ
Гладкие мышцы
Костная ткань
Кровь лягушки
Кровь человека
Однослойный эпителий
Источник
Приготовление препаратов для микроскопирования
 |  | |
 | Практические советы Витальное окрашивание Прижизненное окрашивание Домашняя лаборатория Занимательная микроскопия Изготовление микропрепаратов Камера Горяева Классификация и маркировка объективов микроскопов Комбинации цветных стекол для выделения спектра Методы микроскопирования Методы исследования простейших Методы и приемы биологического эксперимента Микроскопия для начинающих Микроскопические измерения Модификации контрастной окраски по Граму Необходимое оборудование Общие методы заключения препаратов Организация и оснащение гистологической лаборатории Освещение по Келлеру Подготовка предметных стекол Поляризационная микроскопия Правила работы с микроскопом Правила ведения лабораторного журнала Приобретение микроскопа Приготовление микропрепаратов членистоногих Техника приготовления гистологических препаратов Фототубус для цифровых камер Формидрон инструкция по применению |  |
 |  |
 |  | |
 | |  |
 |  |  |
 |  | |
 | |  |
 |  |  |
 |  | |
 | |  |
 |  |  |
 |  | ||||||||||
 |
|  | |||||||||
 |  |
 |  | ||||||
 |
|  | |||||
 |  |  | |||||
 |  | |
 | |