- Реакция термического разложения перманганата калия
- Приготовление раствора, содержащего смесь из комбинации ионов
- Реакция термического разложения перманганата калия
- Приготовление раствора, содержащего смесь из комбинации ионов
- Можно ли приготовить растворы которые одновременно содержали бы AlCl3 и NaOH , Al2(SO4)3 и Ba(NO3)2 , KAlO2 и HCl Почему?
- Составте ионые уравнения :1?
- Допишите уравнения возможных реакций Ba(OH)2 + HCL = K2S + H2SO4 = BaCl2 + MgSO4 = NaNO3 + MgCl2 = AgNO3 + ALCL = CaCO3 + HCL = FeCl2 + NaOH =?
- Составьте уравнения возможных реакций, протекающих в растворах веществ, формулы которых :KNO3 + CaCl2 — — > ;Li2CO3 + HCl — — > ;NaOH + H2SO4 — — — > ;BaCl2 + NaOH — — — > ;NaOH + CH3COOH — — ?
- Составьте молекулярное, полное и краткое ионные уравнения взаимодействия между : HCl + Zn и HCl + NaOH?
- ALCL + NAOH AL2O3 + NAOH?
- Что будет?
- Составьте ионное и молекулярное уравнение NaOH + AlCl?
- Как приготовить 0?
- Как уравнять?
- Составьте уравнения химических реакций : CuSO4 + NaOH = Cu(OH)2 + HCl = HCl + NaOH = Zn + HCl = CuO + HCl =?
Реакция термического разложения перманганата калия
Задача 1099.
Написать уравнение реакции термического разложения перманганата калия. К какому типу окислительно-восстановительных превращений относится эта реакция?
Решение:
Уравнение реакции имеет вид:
Здесь марганец уменьшает свою степень окисления от +7 до +6 (является окислителем), а кислород увеличивает сою степень окисления от -2 до 0 (является восстановителем). Реакции, при которых одна составная часть сложного вещества служит окислителем (Mn), а другая – восстановителем (О), называется внутримолекулярной реакцией окисления-восстановления.
Приготовление раствора, содержащего смесь из комбинации ионов
Задача 1100.
Можно ли приготовить раствор, который содержал бы одновременно Sn 2+ и Hg 2+ ; Sn 2+ и Fe 3+ ; SO3 2- и MnO4–; Cr2O7 2- и SO4 2- ? Указать, какие комбинации ионов невозможны и почему.
Решение:
а) В Sn 2+ атом элемента находится в своей промежуточной степени окисления, поэтому ион Sn 2+ будет проявлять восстановительные свойства. В Hg 2+ атом элемента ртути находится в своей высшей степени окисления, поэтому ион Hg 2+ будет проявлять только окислительные свойства.
Уравнения полуреакций процесса окисления-восстановления: 
Таким образом, приготовить раствор, который содержал бы одновременно Sn 2+ и Hg 2+ нельзя, так как будет протекать окислительно-восстановительный процесс.
б) В Sn 2+ атом элемента находится в своей промежуточной степени окисления, поэтому ион Sn 2+ будет проявлять восстановительные свойства. В Fe 3+ атом элемента железа находится в своей высшей степени окисления, поэтому ион Fe 3+ будет проявлять только окислительные свойства. Уравнения полуреакций процесса окисления-восстановления: 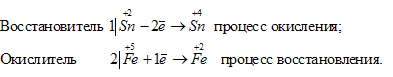
Таким образом, приготовить раствор, который содержал бы одновременно Sn 2 + и Fe 3+ нельзя, так как будет протекать окислительно-восстановительный процесс.
в) В SO3 2- атом элемента серы находится в своей промежуточной степени окисления, поэтому ион SO3 2- будет проявлять восстановительные свойства. В MnO4 – атом элемента марганца находится в своей высшей степени окисления, поэтому ион MnO4 – будет проявлять только окислительные свойства. Уравнения полуреакций процесса окисления-восстановления: 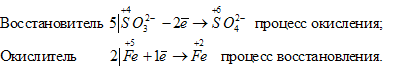
Таким образом, приготовить раствор, который содержал бы одновременно SO3 2- и MnO4 – ; нельзя, так как будет протекать окислительно-восстановительный процесс.
г) В Cr2O7 2- атом элемента хрома находится в своей высшей степени окисления, поэтому ион Cr2O7 2- будет проявлять окислительные свойства. В SO4 2- атом элемента серы находится в своей высшей степени окисления, поэтому ион SO4 2- будет проявлять только окислительные свойства.
Так как в растворе присутствуют ионы Cr2O7 2- и SO4 2- , которые оба проявляют окислительные свойства, то приготовит раствор с одновременным содержанием этих ионов возможно.
Источник
Реакция термического разложения перманганата калия
Задача 1099.
Написать уравнение реакции термического разложения перманганата калия. К какому типу окислительно-восстановительных превращений относится эта реакция?
Решение:
Уравнение реакции имеет вид:
Здесь марганец уменьшает свою степень окисления от +7 до +6 (является окислителем), а кислород увеличивает сою степень окисления от -2 до 0 (является восстановителем). Реакции, при которых одна составная часть сложного вещества служит окислителем (Mn), а другая – восстановителем (О), называется внутримолекулярной реакцией окисления-восстановления.
Приготовление раствора, содержащего смесь из комбинации ионов
Задача 1100.
Можно ли приготовить раствор, который содержал бы одновременно Sn 2+ и Hg 2+ ; Sn 2+ и Fe 3+ ; SO3 2- и MnO4–; Cr2O7 2- и SO4 2- ? Указать, какие комбинации ионов невозможны и почему.
Решение:
а) В Sn 2+ атом элемента находится в своей промежуточной степени окисления, поэтому ион Sn 2+ будет проявлять восстановительные свойства. В Hg 2+ атом элемента ртути находится в своей высшей степени окисления, поэтому ион Hg 2+ будет проявлять только окислительные свойства.
Уравнения полуреакций процесса окисления-восстановления: 
Таким образом, приготовить раствор, который содержал бы одновременно Sn 2+ и Hg 2+ нельзя, так как будет протекать окислительно-восстановительный процесс.
б) В Sn 2+ атом элемента находится в своей промежуточной степени окисления, поэтому ион Sn 2+ будет проявлять восстановительные свойства. В Fe 3+ атом элемента железа находится в своей высшей степени окисления, поэтому ион Fe 3+ будет проявлять только окислительные свойства. Уравнения полуреакций процесса окисления-восстановления: 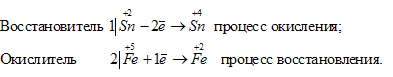
Таким образом, приготовить раствор, который содержал бы одновременно Sn 2 + и Fe 3+ нельзя, так как будет протекать окислительно-восстановительный процесс.
в) В SO3 2- атом элемента серы находится в своей промежуточной степени окисления, поэтому ион SO3 2- будет проявлять восстановительные свойства. В MnO4 – атом элемента марганца находится в своей высшей степени окисления, поэтому ион MnO4 – будет проявлять только окислительные свойства. Уравнения полуреакций процесса окисления-восстановления: 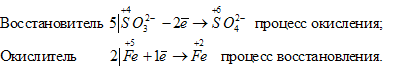
Таким образом, приготовить раствор, который содержал бы одновременно SO3 2- и MnO4 – ; нельзя, так как будет протекать окислительно-восстановительный процесс.
г) В Cr2O7 2- атом элемента хрома находится в своей высшей степени окисления, поэтому ион Cr2O7 2- будет проявлять окислительные свойства. В SO4 2- атом элемента серы находится в своей высшей степени окисления, поэтому ион SO4 2- будет проявлять только окислительные свойства.
Так как в растворе присутствуют ионы Cr2O7 2- и SO4 2- , которые оба проявляют окислительные свойства, то приготовит раствор с одновременным содержанием этих ионов возможно.
Источник
Можно ли приготовить растворы которые одновременно содержали бы AlCl3 и NaOH , Al2(SO4)3 и Ba(NO3)2 , KAlO2 и HCl Почему?
Химия | 10 — 11 классы
Можно ли приготовить растворы которые одновременно содержали бы AlCl3 и NaOH , Al2(SO4)3 и Ba(NO3)2 , KAlO2 и HCl Почему?
В растворе эти вещества будут реагировать (они не могут существовать в растворах независимо друг от друга, следовательно, вопрос сформулирован некорректно).
AlCl₃ + 3NaOH = Al(OH)₃ + 3NaCl
Al³⁺ + 3OH⁻ = Al(OH)₃ (осадок белого цвета)
Al(OH)₃ + NaOH = Na[Al(OH)₄] Al(OH)₃ + OH⁻ = [Al(OH)₄]⁻(будет раствор)
Al₂(SO₄)₃ + 3 Ba(NO₃)₂ = 2Al(NO₃)₃ + 3 BaSO₄
3SO₄²⁻ + 3 Ba²⁺ = BaSO₄ (осадок белого цвета)
KAlO₂ + 4HCl = KCl + AlCl₃ + 2H₂O
AlO₂⁻ + 4H⁺ = Al³⁺ + 2H₂O (здесь будет раствор, осадка нет).
Составте ионые уравнения :1?
Составте ионые уравнения :
AlCl + NaOH — > ; Al(OH) + NaCl
HAlO + NaOH — > ; NaAlO + HO
Al(OH) + HCl — > ; AlCl + H.
Допишите уравнения возможных реакций Ba(OH)2 + HCL = K2S + H2SO4 = BaCl2 + MgSO4 = NaNO3 + MgCl2 = AgNO3 + ALCL = CaCO3 + HCL = FeCl2 + NaOH =?
Допишите уравнения возможных реакций Ba(OH)2 + HCL = K2S + H2SO4 = BaCl2 + MgSO4 = NaNO3 + MgCl2 = AgNO3 + ALCL = CaCO3 + HCL = FeCl2 + NaOH =.
Составьте уравнения возможных реакций, протекающих в растворах веществ, формулы которых :KNO3 + CaCl2 — — > ;Li2CO3 + HCl — — > ;NaOH + H2SO4 — — — > ;BaCl2 + NaOH — — — > ;NaOH + CH3COOH — — ?
Составьте уравнения возможных реакций, протекающих в растворах веществ, формулы которых :
Составьте молекулярное, полное и краткое ионные уравнения взаимодействия между : HCl + Zn и HCl + NaOH?
Составьте молекулярное, полное и краткое ионные уравнения взаимодействия между : HCl + Zn и HCl + NaOH?
ALCL + NAOH AL2O3 + NAOH?
ALCL + NAOH AL2O3 + NAOH.
Что будет?
Как можно из одного другое получить?
Составьте ионное и молекулярное уравнение NaOH + AlCl?
Составьте ионное и молекулярное уравнение NaOH + AlCl.
Как приготовить 0?
Как приготовить 0.
1N раствор NaOH.
Как уравнять?
AlOH + HCl — — — — — AlCl + H2O NaOH + H3PO4 — — — — — — — — NaPO4.
Составьте уравнения химических реакций : CuSO4 + NaOH = Cu(OH)2 + HCl = HCl + NaOH = Zn + HCl = CuO + HCl =?
Составьте уравнения химических реакций : CuSO4 + NaOH = Cu(OH)2 + HCl = HCl + NaOH = Zn + HCl = CuO + HCl =.
На странице вопроса Можно ли приготовить растворы которые одновременно содержали бы AlCl3 и NaOH , Al2(SO4)3 и Ba(NO3)2 , KAlO2 и HCl Почему? из категории Химия вы найдете ответ для уровня учащихся 10 — 11 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
Fe2O3 + 3H2 — > 2Fe + 3 H2O Fe + 2 HCl — > FeCl2 + H2 FeCl2 + Ba(OH)2 — > BaCl2 + Fe(OH)2↓ Fe(OH)2 — > FeO + H2O (t) BaCl2 + Na2SO4 — > BaSO4↓ + 2NaCl Ba( + 2) + 2Cl( — ) + 2Na( + ) + SO4( — 2) — > BaSO4↓ + 2Na( + ) + 2Cl( — ) Ba( + 2) + SO4( — 2) — ..
108, 5 г х л 2HgO = 2Hg + O2 434 г / моль 22, 4 л / моль х = 108, 5 * 22, 4 / 434 = 5, 6 литра Ответ : 5, 6 литров O2.
Решения на фото : ) Извиняюсь, что красной ручкой.
Это реакция разложения.
А что решать то.
M = 800 (г) M(SO3) = 32 + 3 * 16 = 80 (г / моль) n = m / M = 800 / 80 = 10 (моль) N = Na * n, где Na — число Авагадро = 6. 02 * 10 ^ 23 (молекул / моль) N = 6. 02 * 10 ^ 23 * 10 = 60. 2 * 10 ^ 23 (молекул).
Помогут только с 6 : А 4 Б 3 В 1 Г 2.
Запишем уравнение реакции (в приложенном файле). Посчитаем количество вещества этиленгликоля : n = m / M = 93 / 62 = 1. 5 моль По уравнению реакции гликолята столько же, т. Е. тоже 1, 5 моль. Теперь найдем массу гликолята : m = n * M = 1. 5 * 84..
Cr( + 6)O3(2 — ) K2( + )Cr2( + 6)O7(2 — ) H3( + )P( + 5)O4(2 — ) Cu(2 + )S( + 6)O4(2 — ) Al(3 + )P( + 5)O4(2 — ).
C6H5NO2 + 3H2 = C6H5NH2 + 2H2O n(C6H5NH2 )практич. = 14, 88 / 93 = 0, 16 моль n(C6H5NH2 )теоретич. = 0, 16 / 0, 80 = 0, 2 моль n(H2) = 3n(C6H5NH2 )теоретич. = 0, 6 моль 2RCOOH + Mg = (RCOO)2Mg + H2 n(RCOOH) = 2n(H2) = 1, 2 моль n(C2H5OH) = 0, 5n(R..
Источник









