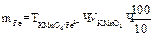Приготовление рабочего раствора перманганата калия.
Приготовить титрованный раствор перманганата калия по точной навеске нельзя, т.к. при растворении KMnO4 в дистиллированной воде происходит частичное восстановление его в MnO2. Поэтому концентрация раствора KMnO4 в первые дни после его приготовления изменяется. Поэтому титр раствора устанавливают через 7-10 дней после его приготовления по исходному веществу-щавелевой кислоте: Н2С2О4 •2Н2О. Для приготовления 1л 0,05н раствора KMnO4 берут навеску:
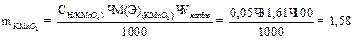
Взятую навеску переносят в мерную колбу на 1 л, растворяют в дистиллированной воде и оставляют стоять 7-10 дней, а затем фильтруют через стеклянный фильтр в другую склянку из темного стекла.
Приготовление рабочего раствора щавелевой кислоты.
Щавелевая кислота реагирует с перманганатом калия в кислой среде по уравнению:
Молярная масса эквивалента щавелевой кислоты равна:
М(э) Н2С2О4 •2Н2О= 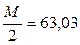
1. для приготовления 100 мл 0,05 н раствора щавелевой кислоты берут навеску :
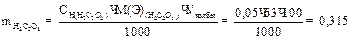
2. взятие навески: масса бюкса с веществом —————-г
масса пустого бюкса —————-г
3. навеску щавелевой кислоты переносят в мерную колбу на 100 мл, растворяют в дистиллированной воде, доводят объем водой до метки.
4. нормальную концентрацию щавелевой кислоты вычисляют по формуле:

Установка молярной концентрации эквивалента, нормальной концентрации (титра) раствора перманганата калия.
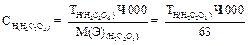
1.Бюретку, предварительно ополоснув приготовленным раствором KMnO4, заполняют этим раствором.
2.Отбирают аликвотную часть (пипеткой 10 мл) раствора щавелевой кислоты и переносят в коническую колбу для титрования, добавляют 10 мл 2н раствора H2SO4 и нагревают до 60-70 о С. Нагревание необходимо для ускорения взаимодействия MnO4 — c С2О4 2- . Горячий раствор медленно титруют из бюретки по каплям раствором KMnO4 до появления неисчезающей бледно-розовой окраски. Объемы раствора KMnO4 отсчитывают по верхнему краю мениска.
Результаты трех титрований заносят в тетрадь.
Нормальную концентрацию раствора KMnO4 вычисляют по формуле:
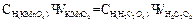
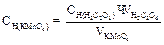
КОНТРОЛЬНАЯ ЗАДАЧА
Определение содержания железа (II) в соли Мора.
Определение эквивалентного железа основано на окислении его перманганатом калия в кислой среде по реакции:
10 5 Fe 2+ -ẽ→Fe 3+
Определение железа проводят в растворе двойной соли сульфата железа-аммония (соли Мора) (NH4)2•Fe(SO4)2•6H2O являющейся более устойчивой к действию кислорода воздуха, чем FeSO4•7H2O.
1. полученный в мерной колбе раствор соли Мора доводят водой до метки.
2. отбирают аликвотную часть (10,0 мл) пипеткой, переносят в коническую колбу для титрования, добавляют мерным цилиндром 10 мл 2 н раствора. Заполняют бюретку стандартизированным раствором KMnO4.
3. исследуемый раствор титруют на холоде (18-25 о С), т.к. при повышении температуры скорость окисления Fe 2+ кислородом воздуха сильно возрастает. Хлориды мешают перманганатометрическому определению, вследствие возникновения сопряженной реакции окисления ионов С1 — перманганатом,это вызывает дополнительный расход KMnO4, и результаты титрования получаются неточными. Титрование проводят до появления бледно-розовой окраски, не исчезающей в течении 1-2 мин. Результаты трех титрований заносят в тетрадь:
V Fe 2+ , мл V KMnO4,мл
Вычисление граммового содержания железа в 100 мл раствора соли Мора.
1 способ: 1) вычисление нормальной концентрации раствора соли Мора:

2) вычисление граммового содержания:
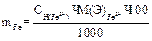
2 способ: 1) вычисление титра раствора KMnO4:
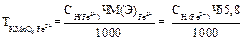
2) вычисление граммового содержания железа в 100 мл раствора соли Мора:
1.4.2 Лабораторная работа № 4.
ИОДОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ (ИОДОМЕТРИЯ)
Иодометрия представляет собой метод титриметрического анализа, основанного на использовании обратимого окислительно-восстановительного процесса, протекающего по схеме:
Нормальный окислительно-восстановительный потенциал равен +0,54 в. Поэтому более сильные окислители окисляют ион I — до свободного иода I2, а окислительно-восстановительные пары с меньшими окислительными потенциалами способны восстанавливать свободный иод до ионов иодида. Следовательно, иодометрия может применяться для определения восстановителей:Na2S2O3, H2SO3, H2S и для определения окислителей: KMnO4, K2Cr2O7, Cl2, Br2.
Рабочим раствором является раствор свободного иода, окисляющего восстановителя по схеме:
Определение восстановителей производят или непосредственным титрованием рабочим раствором иода, или способом обратного титрования. Для этого к определенному объему восстановителя добавляют в избытке определенный объем титрованного раствора иода, а затем избыток иода оттитровывают вторым рабочим раствором-тиосульфатом натрия.
Титрование растворами свободного иода проводят в кислой или нейтральной среде, т.к. при рН=8 протекает побочная реакция.
Определять окислителей прямым титрованием раствором иодида калия нельзя, т.к. в точке эквивалентности прекращается выделение свободного иода, но этот момент зафиксировать визуально невозможно.
Иодометрические определения окислителей производят не прямым, а косвенным методом ( метод замещения).
К раствору, содержащему сильную кислоту (H2SO4, HCl), приливают избыток КI и точный отмеренный объем раствора определяемого окислителя. При этом выделяется эквивалентное окислительное количество иода:
Выделившейся иод титруют раствором восстановителя-тиосульфатом натрия, который является вторым раствором в иодометрии.
Определяемый окислитель замещается эквивалентным количеством другого окислителя-иода, который и титруется раствором восстановителя-тиосульфата. Этот прием «косвенного» определения называется методом замещения, что значительно расширяет область применения объемного анализа.
Титрование проводится на холоде, т.к иод –вещество летучее. При титровании окислителей необходимо добавлять большой избыток, что ускорит реакцию, кроме того, избыток KI необходим для растворения выделившегося иода KI+I2→K[I3], т.к.в воде иод плохо растворяется. Комплексная соль разлагается при титровании иода тиосульфатом натрия. Реакция между иодидом калия и окислителем протекает во времени . Титрование выделившегося иода следует начинать через 5 мин после прибавления окислителя. Эквивалентная точка в иодометрии определяется с помощью индикатора –раствора крахмала. Чувствительность крахмала к водному раствору иода очень большая( одна капля 0, 0001н раствора I2 вызывает появление синего окрашивания в 50 мл раствора, содержащего крахмал) и еще более увеличивается в присутствии KI. Крахмал образует адсорбционное соединение синего цвета в присутствии полииодидиона [I3 — ]. Крахмал добавляют к раствору в конце титрования, когда почти весь иод оттитрован. При титровании восстановителей раствором иода крахмал приливают с самого начала.
Источник
2.3.4. Окислительно-восстановительного титрования
2.3.4.5. Приготовление и стандартизация рабочего раствора
В качестве рабочего раствора в методе перманганатометрии применяют 0,05 моль/л или 0,1 моль/л раствор KMnO4. Даже очень разбавленные растворы перманганата калия интенсивно окрашены. Поэтому фиксируют точку эквивалентности по появлению розовой окраски раствора, вызываемой добавлением лишь одной капли избытка стандартного раствора KMnO4. Его титр нельзя рассчитать по весу растворенного перманганата. Это связано с тем, что продажные препараты KMnO4 относительно высокой чистоты содержат следы хлоридов, нитратов, сульфатов (перманганата в них 99,0-99,6 % масс.). Однако перекристаллизацией из водного раствора можно получить продукт, содержащий 99,6-99,8 % масс. KMnO4. Но даже если взять его точную навеску для приготовления титрованного раствора, то концентрация оказывается несколько меньшей, чем это следовало бы по расчету. Оказывается, что даже в дистиллированной воде хорошего качества обычно присутствуют малые количества восстановителей. Поэтому лучше всего для приготовления стандартного раствора перманганата растворить несколько большее количество KMnO4, чем это требовалось бы по расчету, прокипятить раствор, охладить, а затем устанавливать его титр.
Для приготовления 1 л раствора перманганата калия с молярной концентрацией эквивалента 0,1 моль/л взвешивают на технических весах 3,16 г KMnO4 (если титрование проводят в кислой среде, то M1/5(KMnO4) = M(KMnO4)/5), раствор нагревают до кипения, дают ему постоять не менее двух недель для того, чтобы завершились все возможные окислительно-восстановительные реакции и полностью прошло осаждение образующегося при этом MnO2. Выдержанный раствор сливают через сифон (раствор можно фильтровать через асбестовую сетку или стеклянный фильтр, но ни в коем случае не через бумажный) и сохраняют в тщательно промытых темных бутылях, так как свет ускоряет разложение KMnO4:
Применяемая для хранения перманганата склянка должна быть снабжена притертой пробкой с целью защиты от соприкосновения с парами веществ, имеющих свойства восстановителей, от пыли, а также с целью исключения его испарения. Притертую пробку предварительно обрабатывают хромовой смесью для удаления органических веществ, а затем дистиллированной водой.
Готовый раствор не должен образовывать при хранении бурый налет двуокиси марганца на стенках посуды, так как его присутствие катализирует процесс дальнейшего разложения перманганата:
Количество двуокиси марганца в этом процессе возрастает, и поэтому действие ее — автокаталитическое. Действие ионов Mn 2+ такое же, так как эти ионы образуют с перманганатом водную двуокись марганца.
Лучший способ приготовления 0,01 М раствора KMnO4 состоит в разбавлении более концентрированного раствора водой, освобожденной от присутствия восстановителей путем перегонки в присутствии перманганата.
Титр раствора KMnO4 с течением времени несколько изменяется, поэтому его необходимо периодически проверять.
Титр раствора KMnO4 устанавливают по щавелевой кислоте H2C2O4 · 2H2O, оксалату аммония (NH4)2C2O4 · H2O, оксалату натрия Na2C2O4, мышьяковистому ангидриду As2O3, гексацианоферрату (II) калия K4[Fe(CN)6] · 3H2O, по металлическому железу, по соли Мора FeSO4 · (NH4)2SO4 · 6H2O, по йодиду калия KI, йодату калия KIO3 и некоторым другим веществам.
Наиболее часто в качестве установочных веществ используются щавелевая кислота и ее соли, так как они легко могут быть очищены от примесей перекристаллизацией из воды. Более удобно пользоваться оксалатом аммония или натрия, концентрация которых не изменяется во времени. Оксалат натрия не содержит кристаллизационной воды и устойчив, но, к сожалению, относительно труднорастворим.
Источник
Можно ли приготовить раствор перманганата калия по точной навеске
Среди растворов окислителей и восстановителей, применяемых в химическом анализе, наибольшее значение имеют растворы перманганата калия, бихромата калия, бромата калия, бромид-бромата калия, йода, йодида калия, тиосульфата натрия, соли Мора, перекиси водорода, щавелевой кислоты и ее солей.
Приготовление растворов перманганата калия и установление их концентрации
Обычно применяют 0,1 н. растворы перманганата калия, реже 0,01 н. Более разбавленные растворы менее устойчивы при хранении, поэтому готовят 0,1 н. раствор перманганата, а растворы с меньшей концентрацией получают путем точного разбавления 0,1 н. раствора непосредственно перед проведением анализов. Для приготовления раствора применяют химически чистый перманганат калия.
Для приготовления 0,1 н. раствора необходимое количество перманганата калия рассчитывают по формуле. Эквивалент перманганата калия 31,60.
После взвешивания навески перманганата калия на техно-химических весах ее растворяют в свежеперегнанной дистиллированной воде (лучше в воде после вторичной перегонки), нагретой до 40°C.
Для растворения берут обычно объем воды, в пять раз меньший требуемого объема раствора. Растворение проходит медленно; для ускорения раствор перемешивают путем вращения сосуда до тех пор, пока при наклоне сосуда на стенках его не будет наблюдаться отсутствие кристалликов перманганата. После полного растворения раствор разбавляют до нужного объема свежеперегнанной дистиллированной водой и хорошо перемешивают.
Содержащиеся в воде примеси органических веществ постепенно окисляются перманганатом и в растворе выделяется двуокись марганца, которая способствует каталитическому разложению перманганата с выделением кислорода. Поэтому после приготовления раствор оставляют стоять в темноте в течение около 10 дней для обеспечения полного окисления органических примесей. Затем раствор отфильтровывают от двуокиси марганца через стеклянный или асбестовый фильтр, после чего устанавливают концентрацию.
Для быстрого приготовления небольшого количества раствора перманганата калия навеску его растворяют в необходимом объеме свежеперегнанной дистиллированной воды, нагревают раствор до кипения, кипятят 1—2 минуты и через 2 часа фильтруют через стеклянный фильтр, а затем устанавливают концентрацию.
Раствор перманганата калия может быть приготовлен из фиксанала, но в этом случае требуется очень чистая вода.
При установлении концентрации раствора перманганата калия в качестве исходных веществ могут служить оксалат натрия, оксалат аммония, щавелевая кислота, титрованный раствор тиосульфата натрия. Наиболее удобным для этой цели является оксалат натрия, так как он не содержит кристаллизационную воду и после его перекристаллизации и сушки в сушильном шкафу при 105—110°С легко получить чистую соль постоянного состава.
При установлении концентрации раствора перманганата калия по оксалату натрия обычно применяют метод титрования навесок, а при использовании раствора оксалата натрия, приготовленного из фиксанала, концентрацию раствора перманганата определяют методом пипетирования.
При методе титрования навесок величина навески оксалата натрия в случае бюретки емкостью 25 мл должна быть около 0,12 г. Три-четыре навески химически чистого оксалата натрия, взвешенные с точностью до 0,0002 г, помещают в конические колбы емкостью 200—250 мл. Каждую навеску растворяют в 30 мл дистиллированной воды и добавляют 20 мл 2 н. серной кислоты. Затем раствор нагревают на водяной бане до 70—80°С (раствор нельзя нагревать до кипения, так как при этом происходит частичное разложение оксалата и перманганата). Нагретый раствор титруют раствором перманганата. Первые капли раствора перманганата обесцвечиваются очень медленно, а затем по мере накопления в растворе ионов двухвалентного марганца, каталитически ускоряющих реакцию, обесцвечивание раствора перманганата идет значительно быстрее.
Титрование ведут так, чтобы новые капли раствора перманганата вводили после обесцвечивания предыдущих.
Титрование заканчивают при появлении розовой окраски раствора, не исчезающей в течение 1 мин. После титрования всех навесок вычисляют концентрацию раствора для каждого титрования:
где m1 — навеска оксалата натрия, г;
V2 — объем раствора перманганата калия, израсходованного на титрование.
Расхождение между отдельными определениями концентрации не должно превышать 0,3%.
Таким же способом можно установить концентрацию раствора перманганата калия методом титрования навесок щавелевой кислоты или навесок оксалата аммония.
При установлении концентрации раствора перманганата калия по щавелевой кислоте часто пользуются 0,1 н. раствором щавелевой кислоты, приготовленным из фиксанала. Если применяют бюретку емкостью 25 мл, то в коническую колбу для титрования отмеривают пипеткой 20 мл 0,1 н. раствора щавелевой кислоты, добавляют 20 мл 2 н. раствора серной кислоты, нагревают раствор на водяной бане до 70°С и титруют раствором перманганата до розового окрашивания. Титрование повторяют три-четыре раза. По этой же методике определяют концентрацию раствора перманганата калия методом пипетирова-ния по раствору оксалата натрия или оксалата аммония.
Нормальную концентрацию раствора перманганата калия рассчитывают по формуле:
где N1 — нормальная концентрация раствора щавелевой кислоты или раствора оксалата;
V1 — объем раствора щавелевой кислоты или раствора оксалата, взятый для титрования;
V2 — объем раствора перманганата, израсходованный на титрование (средний сходящийся результат).
При определении концентрации раствора перманганата калия по титрованному раствору тиосульфата в коническую колбу с притертой пробкой емкостью 300 мл приливают 15 мл 10%-ного раствора йодида калия (или всыпают 1,5 г йодида калия и растворяют его в 15 мл дистиллированной воды). Затем добавляют 15 мл 2 н. раствора серной кислоты и из бюретки приливают 20 мл раствора перманганата. После этого добавляют 100 мл дистиллированной воды и через 1 мин выделившийся йод оттитровывают 0,1 н. раствором тиосульфата натрия до соломенно-желтого окрашивания раствора. Затем приливают 1 мл 0,5%-ного раствора крахмала и продолжают титровать до обесцвечивания окраски раствора (количества растворов указаны для случая, когда титруют из бюретки емкостью 25 мл). Параллельно проводят холостое титрование, при котором вместо раствора перманганата в колбу приливают 20 мл дистиллированной воды.
Нормальную концентрацию раствора перманганата рассчитывают по формуле:
где N1 — нормальная концентрация раствора тиосульфата натрия;
V1 — объем раствора тиосульфата, израсходованного на титрование в основном опыте (средний сходящийся результат);
V0 — объем раствора тиосульфата, израсходованного на титрование в холостом опыте;
V2 — объем раствора перманганата, взятого на титрование.
Раствор перманганата калия хранят в темной бутыли, закрытой пришлифованной стеклянной гладкой резиновой или полиэтиленовой пробками и защищают от действия прямых солнечных лучей, а также от попадания пыли. Если склянка соединяется с бюреткой, то для соединения применяют стеклянный сифон, проходящий через пробку; в другое отверстие пробки вставляют U-образную трубку, которая служит фильтром от пыли.
При титровании раствором перманганата калия применяют бюретки с кранами. Краны на бюретках перед титрованием протирают и слегка смазывают концентрированной серной кислотой (нельзя смазывать вазелином). Титрование раствором перманганата ведут в кислой среде, чтобы концентрация кислоты в растворе к концу титрования была не менее 0,5 г-экв/л. Кислую среду создают серной кислотой (не следует применять соляную кислоту, так как окислительно-восстановительный потенциал перманганата больше окислительного потенциала хлора и в растворе может происходить побочный процесс окисления иона хлора перманганатом).
Пример 1. На титрование навески оксалата натрия 0,1128 г израсходовано 16,90 мл раствора перманганата калия. Определить нормальную концентрацию раствора перманганата.
Нормальная концентрация раствора перманганата калия:
1000 • 0,1128 / 67 • 16,9 = 0,09970 н.
Пример 2. Определить нормальную концентрацию раствора перманганата калия, если на титрование 15,00 мл 0,1000 н. раствора щавелевой кислоты расходуется 15,20 мл раствора перманганата.
Нормальная концентрация раствора перманганата калия:
0,1000 • 15 / 15,20 = 0,09868 н.
Пример 3. Определить нормальную концентрацию раствора перманганата калия, если при установлении его концентрации по титрованному раствору тиосульфата натрия на 20 мл раствора перманганата израсходовано 19,80 мл 0,1012 н. раствора тиосульфата натрия, а в холостом опыте расход тиосульфата натрия составил 0,10 мл.
Нормальная концентрация раствора перманганата калия:
0,1012(19,8 —  0,1) / 20 = 0,09968 н.
Приготовление растворов бихромата калия и установление их концентрации
Растворы бихромата калия K2Cr2O7 отличаются хорошей устойчивостью при хранении. В техническом анализе применяют 0,1 н. раствор бихромата.
Для приготовления рабочего раствора бихромата пользуются точной навеской химически чистого препарата, перекристаллизованного и высушенного при 150—200°С путем ее растворения в соответствующем объеме воды в мерной колбе.
Концентрацию полученного раствора вычисляют по величине навески:
N = 1000mн / 49,032 • V,
где mн — масса навески, г;
V — объем раствора, мл.
Точный раствор бихромата можно получить также растворением фиксанала бихромата калия.
Большие количества раствора бихромата калия готовят как приблизительные растворы из химически чистого препарата, взвешивая навеску на техно-химических весах. Концентрацию этих растворов затем уточняют титрованием.
Массу навески определяют из приведенного выше уравнения.
Концентрацию бихромата калия устанавливают по титрованному 0,1 н. раствору тиосульфата натрия. При применении бюретки емкостью 25 мл в коническую колбу с притертой пробкой емкостью 300 мл приливают из бюретки или пипеткой 20 мл раствора бихромата калия, вносят 1,5 г йодида калия (или 1 мл свежеприготовленного 10%-ного раствора йодида калия) и 5 мл концентрированной соляной кислоты или 7 мл раствора серной кислоты (1:2); раствор хорошо перемешивают, оставляют в темном месте на 5 мин, добавляют 150 мл дистиллированной воды и выделившийся йод титруют 0,1 н. раствором тиосульфата натрия до желтовато-зеленой окраски. Затем добавляют 1 мл 0,5%-ного раствора крахмала, после чего титруют до резкого перехода синей окраски раствора в светло-зеленую. Параллельно проводят холостое титрование, при котором вместо раствора бихромата берут 20 мл дистиллированной воды.
Нормальную концентрацию раствора бихромата калия рассчитывают по формуле для расчета концентрации перманганата калия.
Растворы бихромата калия хранят в склянках, плотно закрытых резиновыми или полиэтиленовыми пробками. Для титрования бихроматом используют бюретки с кранами. Титрование ведут в кислой среде, чтобы концентрация кислоты в растворе к концу титрования была не менее 1 г-экв/л. Для создания кислой среды можно применять серную или соляную кислоты.
Пример 4. Определить нормальную концентрацию раствора бихромата калия, если 4,8634 г химически чистого бихромата калия были растворены в воде в мерной колбе емкостью 1 л.
1000 • 4,8634 / 49,032 • 1000 = 0,09919 н.
Пример 5. Определить нормальную концентрацию раствора бихромата калия, если при установлении его концентрации по раствору тиосульфата натрия было взято 20 мл раствора бихромата, а на титрование было израсходовано 20,20 мл 0,09980 н. раствора тиосульфата в основном опыте и 0,20 мл в холостом опыте.
0,09980 • (20,2-0,2) / 20 = 0,9980 н.
Приготовление растворов йода и установление их концентрации
В техническом анализе применяют 0,1; 0,05; 0,02 н. растворы йода в водных растворах йодистого калия, а также 0,2 н. спиртовый раствор йода.
Раствор йода точной концентрации можно получить непосредственно растворением точной навески йода, очищенного предварительно возгонкой, или растворением фиксанала йода. Раствор йода может быть приготовлен также из чистого для анализа препарата, не подвергнутого возгонке, с последующей установкой нормальности полученного раствора по раствору тиосульфата натрия.
Для приготовления раствора навеску йода вычисляют по формуле. Эквивалент йода 126,9.
При приготовлении водных растворов навеску йода вначале растворяют в концентрированном растворе йодистого калия. На каждый 1 л 0,1 н. раствора йода берут концентрированный раствор, содержащий 35 г йодида калия в 25 мл воды (количество йодида калия должно быть в три раза больше количества йода).
Если раствор готовят из йода, очищенного возгонкой, то в бюксе в дистиллированной воде растворяют йодид калия, получая концентрированный раствор; после того как раствор примет температуру окружающего воздуха (при растворении происходит охлаждение), бюкс закрывают крышкой и взвешивают на аналитических весах. Затем на техно-химических весах в другом бюксе или на часовом стекле отвешивают навеску йода после возгонки и переносят ее в бюкс с раствором йодида калия. Бюкс закрывают крышкой и снова взвешивают на аналитических весах. Массу навески йода находят по разности результатов взвешивания. Раствор из бюкса через воронку переливают в мерную колбу, тщательно промывают бюкс и воронку дистиллированной водой. Взбалтывают раствор в колбе до полного растворения йода и доливают водой до метки.
Нормальную концентрацию полученного раствора йода рассчитывают по формуле:
где mн — масса навески йода, г;
V — объем мерной колбы, мл.
При приготовлении водного раствора из препарата йода, не подвергнутого возгонке, навеску йода, взвешенную на техно-химических весах, растворяют в концентрированном растворе йодистого калия, приготовленном в колбе или склянке, а затем доливают необходимое количество воды до полного объема раствора и хорошо перемешивают.
Спиртовый раствор йода получают растворением навески йода в соответствующем объеме 95%-ного спирта с последующим определением нормальности полученного раствора по титрованному раствору тиосульфата натрия.
Установление и проверку концентрации раствора йода по титрованному раствору тиосульфата проводят незадолго перед использованием раствора йода для анализов, так как концентрация его быстро изменяется вследствие летучести йода. Если для титрования применяют бюретку емкостью 25 мл, то для установления концентрации в коническую колбу с притертой пробкой наливают из бюретки или пипеткой 20 мл раствора йода, добавляют 20 мл дистиллированной воды и титруют раствором тиосульфата натрия до желтого окрашивания раствора. Затем добавляют 1 мл 0,5%-ного раствора крахмала и продолжают титрование до обесцвечивания. Нормальные концентрации растворов йода и тиосульфата должны быть близкими по величине.
Концентрацию раствора йода рассчитывают по формуле:
где N1 — нормальная концентрация раствора тиосульфата;
V1 — объем раствора тиосульфата, израсходованный на титрование;
V2 — объем оттитрованного раствора йода.
Растворы йода хранят в склянках из темного стекла, закрытых хорошо пришлифованными стеклянными пробками. Концентрацию растворов проверяют не реже одного раза в месяц, а если растворы используют не часто, то проверку проводят перед каждой новой серией анализов.
Титрование растворами йода проводят только из бюреток с кранами. Нельзя применять бюретки с резиновыми насадками. Титрование йодом можно вести в кислой, нейтральной и слабощелочной средах до pH=9. Нельзя титровать в сильнощелочной среде, так как при pH>9 йод переходит в йодноватистокислый натрий, не дающий реакции с крахмалом.
Пример 6. Рассчитать количество воды и йодида калия для приготовления 2 л 0,1 н. раствора йода.
Масса навески йода:
126,9 • 0,1 • 2000 / 1000 = 25,4 г.
Масса йодида калия 35 • 2 = 70 г.
Пример 7. Определить нормальную концентрацию раствора йода, если на титрование 15,00 мл этого раствора израсходовано 14,95 мл 0,1014 н. раствора тиосульфата натрия.
0,1014 • 14,95 / 15 = 0,01011 н.
Приготовление растворов тиосульфата натрия и установление их концентрации
Для анализа обычно применяют 0,1 н. растворы тиосульфата натрия (реже 0,01 н.). Тиосульфат натрия является довольно сильным восстановителем, но его растворы имеют хорошую устойчивость при хранении, если в них не попадают вещества, создающие кислую среду, окислители и тиобактерии, способные размножаться в растворах тиосульфата, разлагая его.
Растворы тиосульфата готовят из чистого для анализа препарата, представляющего собой кристаллогидрат.
Количество тиосульфата, необходимое для приготовления раствора, вычисляют по формуле. Эквивалент кристаллогидрата тиосульфата 248,2.
Для растворения берут объем воды, равный объему раствора. Навеску тиосульфата взвешивают на техно-химических весах и растворяют в нужном объеме дистиллированной воды, не содержащей углекислого газа (свежеперегнанной и охлажденной). В раствор добавляют карбонат натрия из расчета 0,1 г карбоната на 1 л раствора. Раствор оставляют стоять в темном месте 8—10 дней и после этого устанавливают его концентрацию, применяя в качестве исходных веществ бихромат калия, марганцевокислый калий, йод, йодат калия и другие окислители.
Установление концентрации по бихромату калия можно проводить методом титрования навесок и методом пипетирования. При установлении концентрации методом титрования навесок в отдельные бюксы берут 3—4 навески химически чистого бихромата калия дважды перекристаллизованного и высушенного при 150—200°С. При определении концентрации 0,1 н. раствора тиосульфата натрия и применении для титрования бюретки емкостью 25 мл масса каждой навески должна быть около 0,1 г, точность взвешивания до 0,0002 г.
Каждую навеску переносят в коническую колбу с притертой пробкой емкостью 300 мл и растворяют в 50 мл дистиллированной воды. Затем добавляют 1,5 г химически чистого йодида калия или 15 мл свежеприготовленного 10%-ного раствора йодида калия и 5 мл серной кислоты (1:2). Раствор хорошо перемешивают, оставляют стоять в темном месте 5 минут, добавляют 150 мл дистиллированной воды и выделившийся йод титруют раствором тиосульфата до желтовато-зеленой окраски раствора, добавляют 1 мл 0,5%-ного раствора крахмала и титруют до резкого перехода синего цвета раствора в ярко-зеленый.
Параллельно титрованию отдельных навесок проводят холостое титрование без навески бихромата.
Нормальную концентрацию раствора тиосульфата рассчитывают по формуле:
где mн — масса навески бихромата калия, г;
V2 — объем раствора тиосульфата, израсходованный на титрование в основном опыте, мл;
V0 — объем раствора тиосульфата, израсходованный на холостое титрование, мл.
Установление концентрации раствора тиосульфата натрия по раствору бихромата методом пипетирования проводят так же, как и установление концентрации раствора бихромата по раствору тиосульфата. Этим методом, в частности, пользуются, когда раствор бихромата калия приготовлен из фиксанала.
Нормальную концентрацию раствора тиосульфата натрия при этом методе рассчитывают по формуле:
где N1 — нормальная концентрация раствора бихромата калия;
V1 — объем раствора бихромата;
V2 — объем раствора тиосульфата, израсходованный на титрование;
V0 — объем раствора тиосульфата, израсходованный на холостое титрование (в опыте без раствора бихромата).
Установление концентрации раствора тиосульфата по раствору перманганата калия ведут методом пипетирования, подобно установлению концентрации раствора перманганата по раствору тиосульфата.
Нормальную концентрацию раствора тиосульфата натрия при этом методе вычисляют по формуле:
где N1 — нормальная концентрация раствора перманганата;
V1 — объем раствора перманганата, взятый для титрования;
V2 — объем раствора тиосульфата, пошедший на титрование;
V0 — объем раствора тиосульфата, израсходованный на холостое титрование (в опыте без раствора перманганата).
Растворы тиосульфата натрия хранят в темных склянках, плотно закрытых пробками, что защищает их от действия углекислого газа. Если склянка сообщается с бюреткой, ее закрывают пробкой с хлоркальциевой трубкой, заполненной натронной известью. Если в растворе выпал осадок серы, то его нужно заменить новым, но склянку следует предварительно тщательно промыть хромовой смесью для уничтожения тиобактерий, вызвавших разложение тиосульфата. Концентрацию раствора тиосульфата проверяют не реже одного раза в три месяца.
Растворы тиосульфата применяют при анализе для оттитровывания йода. Хотя тиосульфат взаимодействует со многими окислителями, по продукты, образующиеся при этом, бывают различны по составу (политионаты, сульфат). При взаимодействии с йодом тиосульфат окисляется до тетратионата:
Тиосульфатом титруют кислые, нейтральные и слабощелочные растворы, содержащие йод. При титровании кислых растворов необходимо раствор хорошо перемешивать и приливать тиосульфат по каплям. Через 10—15 мин после титрования кислые растворы иногда снова синеют вследствие медленного окисления йодида кислородом воздуха, но на это не следует обращать внимания.
Пример 8. Определить массу навески кристаллогидрата тиосульфата натрия для приготовления 5 л 0,1 н. раствора тиосульфата.
248,2 • 0,1 • 5000 / 1000 = 125 г.,
Пример 9. При установлении концентрации раствора тиосульфата натрия по бихромату навеска бихромата калия имела массу 0,1252 г.
На титрование в основном опыте израсходовано 28,40 мл раствора тиосульфата натрия, а в холостом опыте — 0,10 мл. Определить нормальную концентрацию раствора тиосульфата натрия:
1000 • 0,1252 / 49,032(28,4 — 0,1) = 0,09024 н.
Пример 10. Определить массу отдельной навески бихромата калия для определения концентрации 0,1 н. раствора тиосульфата натрия, если для титрования служит бюретка емкостью 50 мл.
Предполагаем израсходовать на титрование 30 мл раствора тиосульфата.
Масса навески бихромата калия:
49 • 0,1 • 30 / 1000 = 1,5 г.
Пример 11. При установлении концентрации раствора тиосульфата натрия по раствору перманганата было взято 25,00 мл 0,09820 н. раствора перманганата калия. На титрование было израсходовано 24,80 мл раствора тиосульфата, а в холостом титровании — 0,20 мл. Определить нормальную концентрацию раствора тиосульфата.
Приготовление раствора йодистого калия. В качестве вспомогательного раствора при йодометрическом титровании применяют 10%-ный раствор йодида калия, который готовят растворением навески х. ч. йодида калия, взвешенной на техно-химических весах, в дистиллированной воде, свободной от углекислого газа (свежепрокипяченной). Этот раствор, особенно на свету и в присутствии кислот, быстро окисляется кислородом воздуха. Поэтому при анализе пользуются только свежеприготовленным раствором.
Количество йодида калия для приготовления 10%-ного раствора вычисляют по формуле.
Раствор хранят в склянке из темного стекла, плотно закрытой пробкой.
Пример 12. Определить количество йодистого калия и количество воды, необходимое для приготовления 500 г 10%-ного раствора йодистого калия.
Количество йодида калия:
10 • 500 / 100 = 50 г.
500 — 50 = 450 г = 450 мл.
Приготовление растворов соли Мора и сульфата закиси железа и установление их концентраций
При количественном анализе окислителей часто применяют 0,1 н. раствор соли Мора или раствор сульфата закиси железа. Соль Мора (сульфат аммония и закисного железа) Fe(NH4)2(SO4)2 • 6Н2O при хранении в закрытых банках долго сохраняет свой состав, заметно не окисляясь и не подвергаясь выветриванию. Она имеет большую эквивалентную массу, что уменьшает относительную ошибку при взвешивании. Однако соль Мора загрязнена соединениями магния, цинка и марганца, которые не удаляются при перекристаллизации, так как кристаллы изоморфны кристаллам соли Мора. Поэтому из нее готовят приблизительные растворы, уточняя затем концентрацию титрованием. Вместо соли Мора может быть использован сульфат закисного железа FeSO4 • 7H2O.
Соль Мора или сульфат закиси железа растворяют в воде, содержащей серную кислоту, для предупреждения гидролиза этих солей в растворе и замедления окисления ионов двухвалентного железа кислородом воздуха. Эти растворы нельзя хранить длительное время, так как ионы двухвалентного железа постепенно окисляются и концентрация их заметно снижается.
Массы навесок солей закисного железа для приготовления 0,1 н. раствора рассчитывают по формуле. Эквивалент соли Мора 392, сульфата закисного железа 278.
Для приготовления растворов используют химически чистой соли. На каждый литр раствора берут 100 мл концентрированной серной кислоты. Объем воды для приготовления раствора находят по разности объемов раствора и кислоты (если раствор готовят не в мерной колбе). К половине общего объема доливают серную кислоту, затем в этом растворе растворяют соль Мора или сульфат закиси железа, после чего раствор разбавляют дистиллированной водой до нужного объема, перемешивают и, при наличии осадка, фильтруют через стеклянный фильтр.
Концентрацию растворов соли Мора и сульфата закиси железа можно определить по 0,1 н. раствору перманганата калия или по 0,1 н. раствору бихромата калия.
Для установления концентрации по раствору перманганата калия 20 мл раствора соли Мора или раствора сульфата закиси железа помещают в коническую колбу для титрования, доливают 2 мл 80%-ной ортофосфорной кислоты (для связывания ионов трехвалентного железа в бесцветный комплекс) и титруют 0,1 н. раствором перманганата калия до розового окрашивания, не исчезающего в течение 30 с.
При установлении концентрации по раствору бихромата калия 20 мл раствора соли Мора или раствора сульфата закиси железа вносят в колбу для титрования, приливают 150 мл свежепрокипяченной и охлажденной дистиллированной воды и 8 мл химически чистой концентрированной серной кислоты, добавляют 0,5 мл 1%-ного раствора фенилантраниловой кислоты и титруют 0,1 н. раствором бихромата калия до появления вишневокрасного окрашивания.
Концентрацию растворов соли Мора или сульфата закиси железа N2 вычисляют по формуле:
где N1 — нормальная концентрация раствора перманганата или раствора бихромата;
V1 — объем раствора перманганата или раствора бихромата, израсходованный на титрование;
V2 — объем оттитрованного раствора соли Мора или раствора сульфата закиси железа.
Растворы соли Мора и сульфата закиси железа хранят в склянках, закрытых резиновыми или полиэтиленовыми пробками.
Проверку концентрации этих растворов проводят перед каждой серией анализов.
Пример 13. Рассчитать количества соли Мора и серной кислоты, потребные для приготовления 2 л 0,1 н. раствора.
Количество соли Мора:
392 • 0,1 • 2000 / 1000 = 80 г.
Количество концентрированной серной кислоты:
Пример 14. Определить нормальную концентрацию раствора сульфата закиси железа, если на титрование 20 мл раствора израсходовано 19,25 мл 0,1071 н. раствора перманганата калия:
Источник