«Замерзание» воды при комнатной температуре (кристаллизация ацетата натрия)
“Замерзание” воды при комнатной температуре
(кристаллизация ацетата натрия)
Ацетат натрия CH3COONa*3H2O представляет собой
бесцветные кристаллы, легко растворимые в воде. Как видно из формулы,
соль образует кристаллогидрат с тремя молекулами воды.
Если кристаллогидрат ацетата натрия осторожно нагреть – он
расплавиться. Но это плавление не совсем обычное – соль растворяется в
собственной гидратной воде. При охлаждении этот раствор застывает,
превращаясь в белую массу, похожую на лед – происходит кристаллизация,
которая сопровождается значительным выделением тепла.
Подобным образом ведут себя и некоторые другие соли, например – алюмокалиевые квасцы KAl(SO4)2*12H2O.
Однако, ацетат натрия склонен образовывать пересыщенные растворы – т.е.
растворы, которые содержат вещества больше, чем может раствориться при
данной температуре. Если твердый ацетат натрия (с небольшими добавками
воды) нагреть на водяной бане в закрытой колбе, он постепенно
расплавиться, образуя насыщенный раствор. Насыщенный – при температуре
горячей водяной бани.
Теперь снимем колбу с водной бани и оставим охлаждаться. Раствор
постепенно остынет до комнатной температуры, растворимость соли
значительно понизится, но кристаллизации не произойдет – образуется
пересыщенный раствор. В закрытой колбе пересыщенный раствор может
храниться днями, неделями и даже месяцами. Но стоит внести затравку –
небольшой кристаллик ацетата натрия – и, сразу же, произойдет
кристаллизация.
Итак, проведем эксперимент. Возьмите колбу на 200-300 мл и насыпьте в нее ацетат натрия CH3COONa*3H2O
– приблизительно на 2/3 объема. Добавьте примерно 7-10 мл
дистиллированной воды. При этом постарайтесь смыть вниз кристаллы,
прилипшие к горлышку колбы. Колбу плотно закройте резиновой или корковой
пробкой и поставьте на водяную баню. По мере того, как вода будет
нагреваться, ацетат натрия начнет растворяться в собственной
кристаллизационной воде. Аккуратно перемешивайте содержимое колбы.
Необходимо добиться полного растворения соли – чтобы внутри колбы не
осталось кристаллов. Если на поверхности раствора образуется пленка или в
нем плавают кристаллы, которые не желают растворяться – откройте колбу и
добавьте немного воды (примерно 5-10 мл). После полного растворения
соли снимите колбу с водяной бани и дайте ей остыть до комнатной
температуры. Этот процесс можно ускорить, поставив колбу под струю
холодной воды.
В результате у нас есть колба с пересыщенным раствором ацетата
натрия. Поставьте колбу на стол, можно предложить нескольким желающим
убедиться, что она холодная. Слегка смочите водой кончик пальца и
прилепите к нему несколько кристалликов ацетата. Откройте колбу и
незаметно для зрителей стряхните кристаллики в раствор.
В месте, где затравки попадут на поверхность раствора, начнется
быстрая кристаллизация. Весь раствор в колбе за несколько секунд
превратится в белую массу, похожую на лед. Затвердеет даже пленка
раствора на стенках колбы – образуя подобие морозных узоров. Колбу можно
перевернуть вверх дном – из нее не вытечет ни капли. За счет тепла
кристаллизации колба нагреется, в чем могут убедиться все желающие. Это
явление используют в “соляных грелках”. Иногда кристаллизация начинается
в момент открытия колбы – к пробке могли прилипнуть кристаллики,
которые при ее открытии падают в раствор. Роль затравки могут играть не
только кристаллы ацетата натрия, но и пыль и другие посторонние частицы,
поэтому соблюдайте чистоту.
Источник
Насыщенный раствор ацетата натрия как приготовить
Ацетат натрия CH3COONa·3H2O — замечательная соль. Это вещество склонно к образованию пересыщенных растворов, — т.е. растворов, которые содержат больше растворенного вещества, чем может раствориться при данной температуре. Благодаря этому ацетат натрия используют в демонстрационных химических опытах, когда нужно показать «замерзание воды при комнатной температуре». Вариантов такого эксперимента великое множество [1]. Все лимитируется не столько знаниями химии, сколько фантазией экспериментатора. Если фантазия есть — не составит труда придумать свой — новый — вариант.
Но дело не только в имитации замерзания воды. Пересыщенный раствор ацетата натрия может храниться долго. Очень-очень-очень долго. А потом в один момент кристаллизоваться.
Теперь обо всем по прядку.
«Раствор содержит больше растворенного вещества, чем может раствориться при данной температуре» — Как это возможно?
Это возможно благодаря тому, что термодинамическое равновесие не всегда наступает моментально, в некоторых случаях система довольно долго может находиться в неравновесном (метастабильном) состоянии.
Например, оконное стекло — по сути, переохлажденная жидкость. С точки зрения термодинамики жидкость должна течь. А переохлажденная жидкость — кристаллизоваться. Однако оконное стекло имеет очень высокую вязкость, поэтому мы не наблюдаем, как стекло течет или кристаллизуется: при комнатной температуре это требует много времени.
С пересыщенными растворами принцип немного другой. Раствор, насыщенный в горячем состоянии, охлаждают до более низкой температуры. Растворимость вещества понижается [2], и оно должно выпасть в осадок. Обычно так и происходит. Но для образования твердой фазы нужны затравки — мелкие кристаллики данного вещества (роль затравок могут также играть мелкие частички других веществ, царапины на стекле и т.п.)
Если затравок нет — раствор можно переохладить: при охлаждении растворенное вещество не выпадает в осадок, а остается в растворе, хотя его содержание в растворе становится выше предела растворимости. Это возможно далеко не всегда. Как отмечалось, роль затравок могут играть инородные тела — пылинки, царапины на стенках сосудов и т.д. Но в случае с ацетатом натрия получение пресыщенного раствора не составляет труда. Кроме ацетата натрия можно назвать также: тиосульфат натрия Na2S2O3·5H2O (кристаллогидрат), алюминиевые квасцы KAl(SO4)2·12H2O, мочевину.
Например, я готовил пересыщенный раствор ацетата натрия следующим образом. Круглую колбу на 300 мл заполнял на 2/3 твердой солью. Добавлял 7-10 мл дистиллированной воды, закрывал колбу и ставил ее на водяную баню. Нагревал воду на бане до кипения, периодически перемешивая содержимое колбы. Соль CH3COONa·3H2O плавилась в собственной кристаллизационной воде, образовывая раствор.
Важно: нужно, чтобы ВСЯ соль растворилась (расплавилась).
Если внутри колбы остались длинные игольчатые кристаллы, которые не желают растворяться, откройте колбу, добавьте несколько миллилитров дистиллята, закройте, перемешайте, продолжите греть раствор на бане — и так до ПОЛНОГО исчезновения всех кристаллов.
После растворения соли охладите раствор в закрытой колбе ДО КОМНАТНОЙ температуры. Раствор НЕ должен быть теплым! Для ускорения охлаждения колбу можно поставит в сосуд с холодной водой.
После ПОЛНОГО охлаждения раствор готов к эксперименту. Самый простой вариант: открываем колбу, добавляем 1 маленький кристаллик — затравку, и весь раствор в колбе за несколько секунд «замерзает» — кристаллизуется. Содержимое колбы похоже на лед, только лед этот будет не холодный, а горячий — за счет теплоты кристаллизации содержимое колбы греется. Колбу можно перевернуть вверх дном — из нее не вытечет ни капли.
Совет: сразу не переворачивайте, а подождите с минуту, например, займите зрителей разговором. Если сразу перевернуть, немного раствора может все-таки вылиться, поскольку, при кристаллизации выделяется тепло, которое мешает полной кристаллизации. Дайте этому теплу уйти в окружающее пространство — тогда застынет весь раствор.
Теперь, я думаю, понятно, почему раствор перед опытом нужно полностью охлаждать: если раствор ацетата натрия будет теплым, он застынет от контакта с затравкой не полностью.
Пересыщенный раствор можно перелить в различные сосуды, можно соорудить «пирамидку», наливая раствор тонкой струйкой в чашку Петри с затравкой (аккуратно, чтобы фронт кристаллизации не поднялся по струе и не проник в колбу). Можно сделать раствором надписи на стекле или гладкой поверхности, а потом их «кристаллизовать» от контакта с затравкой. (У меня не получилось: кристаллизация начиналась в процессе нанесения раствора: постоянно где-то попадалась затравка). Можно налить раствор в сосуд, а затем прикоснуться к его поверхности пальцем, к которому вы прилепили кристаллик ацетата натрия: от контакта с пальцем раствор кристаллизуется.
Если затравки нет, пересыщенный раствор ацетата натрия может существовать очень долго. Пересыщенный раствор ацетата натрия, кристаллизация которого показана на видео, был приготовлен семь лет назад!
СЕМЬ ЛЕТ НАЗАД! — в 2009 году.
Приготовил я его после серии опытов с ацетатом натрия и оставил. Раствор стоял в колбе, закрытой обычной резиновой пробкой, — и все это время оставался жидким!
Более того: раствор не просто стоял: я его три раза переносил в другое место (два раза был переезд из лаборатории в лабораторию, один раз я забрал раствор из лаборатории домой). Помните пословицу:
Один переезд равен двум пожарам.
Так вот: колба с раствором пережила ТРИ(!) переезда, но раствор остался жидким!
И на этом приключения раствора не закончились: дома кошка перекинула на колбу массивную стеклянную вазу. Ваза разбилась, а тонкая колба уцелела! — Спасло то, что ваза ударила в массивную пробку колбы, а не по ее стенкам.
Пересыщенный раствор пережил и это.
Более того, еще семь лет назад в растворе появились какие-то серые хлопья (вероятно от того, что к ацетату натрия была добавлена не дистиллированная вода, а обычная вода из крана — требовалось добавить немного воды), но хлопья не вызвали кристаллизацию.
Сегодня — через семь лет — открыл колбу и всыпал туда несколько кристалликов ацетата натрия: раствор за несколько секунд закристаллизовался. По колбе сверху вниз прошел белый «ледяной» фронт.
Это реально круто!
Как всегда бывает, серые хлопья испортили картину, собравшись именно у той стенки колбы, которая была обращена к фотоаппарату.
__________________________________________________
1 См. статью: «Замерзание воды» при комнатной температуре (кристаллизация ацетата натрия). Crystallization of Supersaturated Solution of Sodium Acetate. (»Freezing of Water» at Room Temperature) [ссылка]
2 Для простоты изложения мы приняли, что растворимость вещества повышается с температурой (т.е. понижается при охлаждении) — для многих веществ это справедливо. Если температурная зависимость растворимости обратная (растворимость понижается при нагревании) — на суть размышлений это не влияет: охлаждение просто заменяют нагревом.
 Кристаллизация пересыщенного раствора ацетата натрия: раствор был приготовлен семь(!) лет назад Crystallization of supersaturated solution of sodium acetate. This solution was prepared seven(!) years ago |
 |
 |
 |
 |
 |
 |
 |
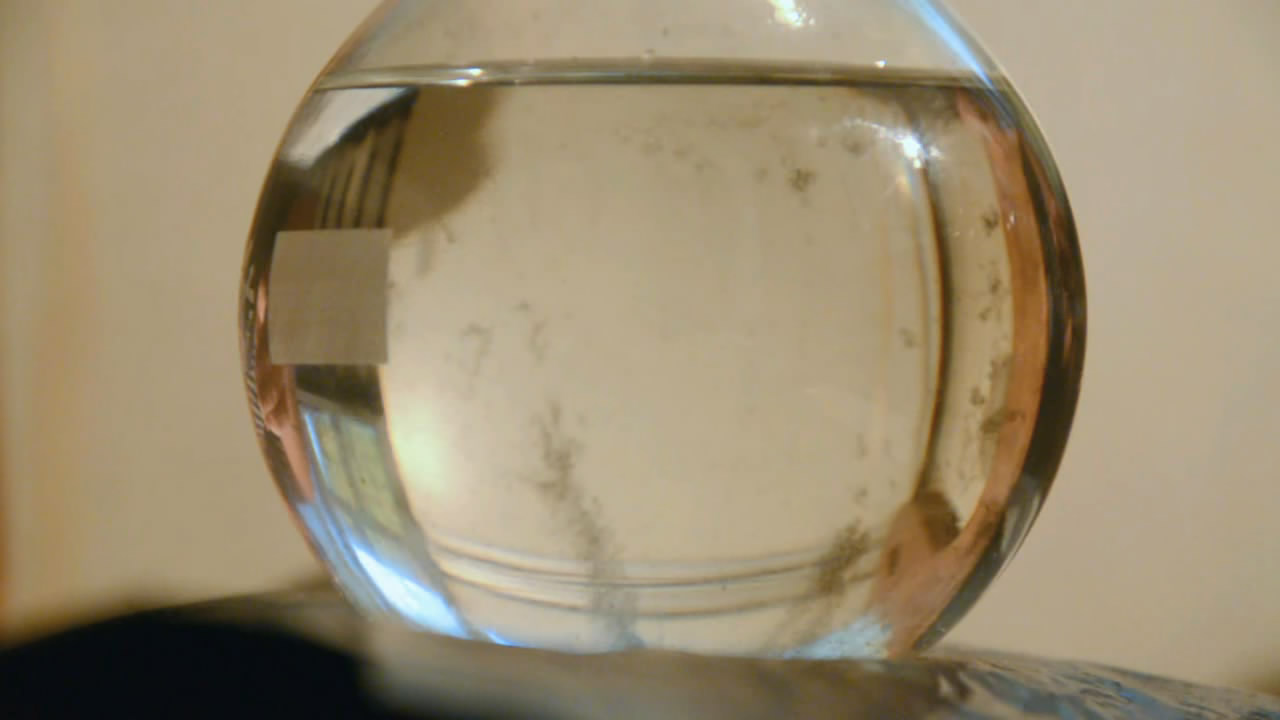 |
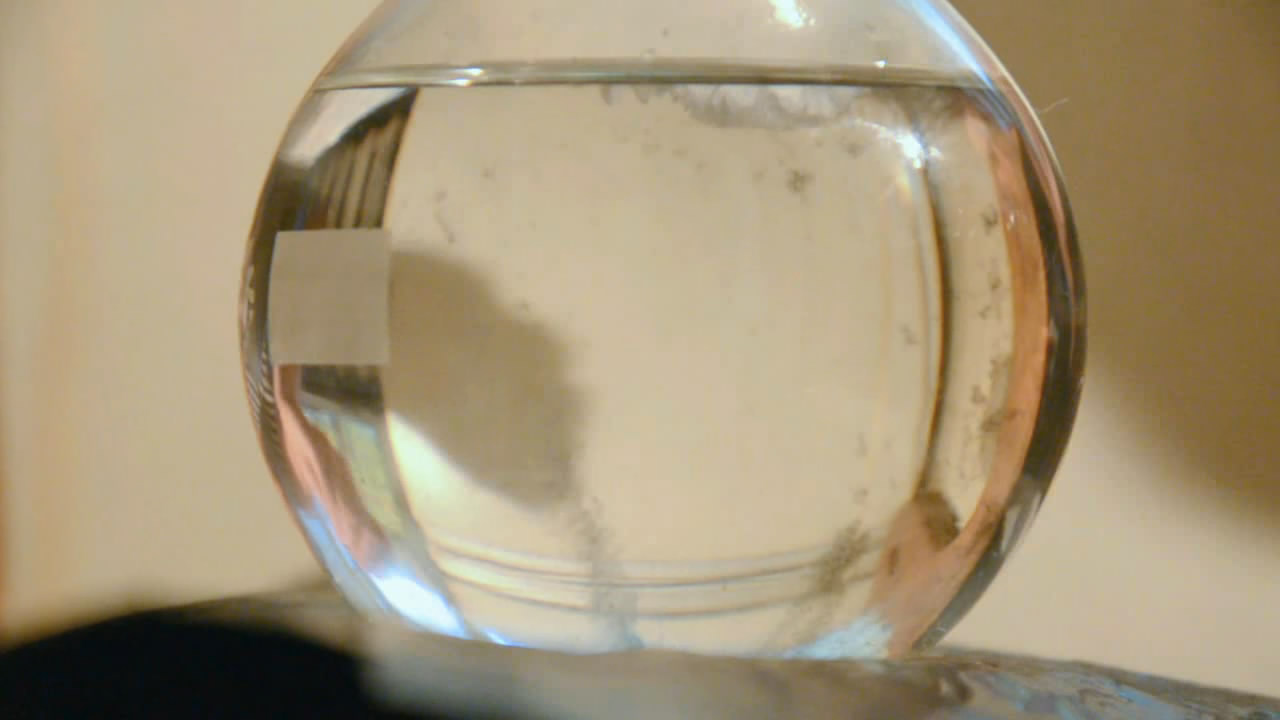 |
 |
 |
 |
 |
 |
 |
 |
 Потом несколько раз растопил закристаллизованный ацетат на водяной бане и охлаждал колбу в ведре с водой. Затем — повторял кристаллизацию. Получились более качественные кадры, и возник соблазн выдать второй, третий и т.д. дубли опыта за первую кристаллизацию (с раствором семилетней выдержки). Но удержался и даю видео, как есть: выше показаны кадры кристаллизации раствора, приготовленного семь лет назад, ниже — даны кадры повторных опытов. Обратите внимание, что в одних случаях фронт кристаллизации напоминает «ледяную стену, которая надвигается», в других случаях ацетат натрия образует «большие иглы, которые быстро растут». Источник |