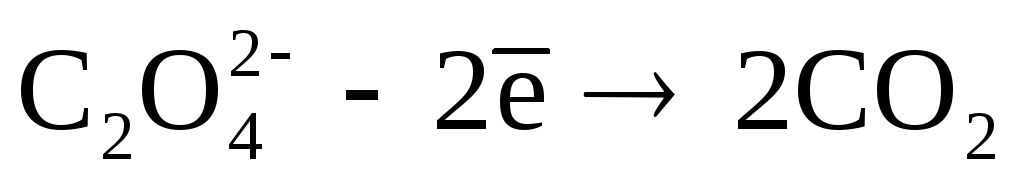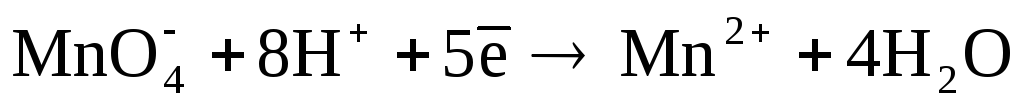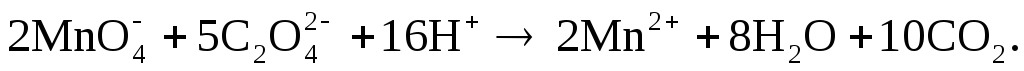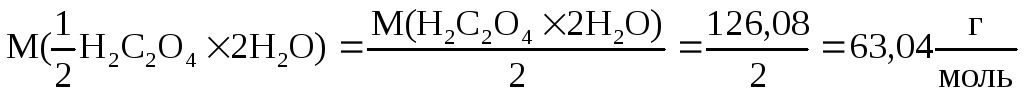Большая Энциклопедия Нефти и Газа
Раствор — щавелевокислый натрий
Растворы щавелевокислого натрия , наоборот, не растворяют гипс и карбонаты и рекомендуются для создания трудно растворимых пленок на поверхности залежей гипса для предохранения их от растворения. При засолении дисперсных пород натриевыми солями происходит замещение в. [1]
Титрование производится 0 45 н раствором щавелевокислого натрия , после осаждения мешающих анализу ионов SO4 1 н раствором уксуснокислого бария. Для устранения влияния сульфатионов не требуется полного удаления их из раствора. Достаточно осадить часть сульфатионов, соответствующую концентрации в 0 02 н, для чего к 100 мл нейтрализата достаточно прибавить 2 мл 1 н раствора уксуснокислого бария. [3]
Как видим, при некоторой пороговой концентрации сульфата натрия стабильность растворов щавелевокислого натрия резко снижается. Величина пороговой концентрации зависит от пересыщения. Чем оно выше, тем меньшее количество примеси требуется для существенного изменения устойчивости раствора. В известной мере механизм действия примеси связан в данном случае с изменением растворимости щавелевокислого натрия. Однако он не может быть сведен только к этому, поскольку, судя по приведенным в работе [56] данным, пересыщение раствора оставалось в рассматриваемой серии опытов постоянным. Наблюдаемое явление может быть связано с изменением ионной силы раствора. Так же могут быть интерпретированы и данные табл. 20 о влиянии на устойчивость растворов пикрата натрия ряда солей. [4]
В коническую колбу емкостью 250 мл отбирают 5 мл электролита, прибавляют 20 мл 2 5 % раствора щавелевокислого натрия и отстаивают 10 — 15 мин. [5]
В коническую колбу емкостью 250 мл отбирают 5 мл электролита, прибавляют 20 мл 2, 5 % раствора щавелевокислого натрия и отстаивают 10 — 15 мин. [6]
Титрование считают законченным, когда получат 4 — 5 показаний лого-метра, указывающих на увеличение электропроводности от прибавления каждой порции раствора щавелевокислого натрия . [7]
Растворы иода или иодноватокислого — калия титруют 0 1 N раствором тиосульфата натрия, который в свою очередь титруют 0 1 N раствором марганцевокислого калия. Марганцевокислый калий титруют 0 1 N раствором щавелевокислого натрия . Раствор приготовляют и титруют следующим образом. [8]
Для приготовления электролита сернокислую медь, щавелевокислый натрий и сернокислый цинк ( каждый компонент в отдельности) растворяют в подогретой ( до 40 С) воде. Затем растворы медной и цинковой солей вливают в раствор щавелевокислого натрия , перемешивая раствор до полного осветления, при этом сначала получается непрозрачный раствор молочно-голубого цвета, который по окончании процесса комплексообразования приобретает прозрачно-синий цвет. После этого отдельно растворяют в горячей воде борную кислоту, вливают ее в приготовленный раствор и добавляют желатину, предварительно растворенную в теплой воде. [9]
В титровальный стакан помещают 100 мл отфильтрованного и охлажденного до комнатной температуры древесного нейтрали-зата и прибавляют количество мл 1 н раствора ацетата бария, равное расходуемому на титрование ионов SO4 в 100 мл нейтра-лизата, или 2 мл 1 н раствора ацетата бария в случае, если содержание сульфатионов не было определено. После добавления уксуснокислого бария сразу же приступают к кондуктометриче-скому титрованию 0 45 н раствором щавелевокислого натрия ( 30 15 г высушенного оксалата натрия в 1 л раствора), добавляя его по 2 мл и отмечая изменение электропроводности раствора. [10]
В титровальный стакан помещают 100 мл отфильтрованного и охлажденного до комнатной температуры древесного нейтрали-зата и прибавляют количество мл 1 н раствора ацетата бария, равное расходуемому на титрование ионов SO4 в 100 мл нейтра-лизата, или 2 мл 1 н раствора ацетата бария в случае, если содержание сульфатионов не было определено. После добавления уксуснокислого бария сразу же приступают к кондуктометриче-скому титрованию 0 45 н раствором щавелевокислого натрия ( 30 15 г высушенного оксалата натрия в 1 л раствора), добавляя его по 2 мл и отмечая изменение электропроводности раствора. [11]
Содержимое колбы взбалтывают и отфильтровывают. В небольшой порции фильтрата ( отдельно) определяют полноту осаждения свинца путем прибавления нескольких капель раствора щавелевокислого натрия . По достижении полноты осаждения в фильтрате определяют РВ. В противном случае опыт повторяют с большим количеством раствора щавелевокислого натрия. [12]
В первом случае отвешивают 4 903 г, а во втором — 2 4515 г, через воронку всыпают в литровую мерную колбу; бюксу или часовое стекло смывают тщательно водой из промывалки, также тщательно обмывают воронку; наполнив колбу на 3 / 4 водой, растворяют соль, затем точно доливают до метки, закрывают пробкой ( стеклянной, хорошо пришлифованной) и основательно перемешивают раствор. Переливают в склянку с притертой пробкой. Хранят его и пользуются им подобно тому, как это указано для раствора щавелевокислого натрия . [13]
Содержимое колбы взбалтывают и отфильтровывают. В небольшой порции фильтрата ( отдельно) определяют полноту осаждения свинца путем прибавления нескольких капель раствора щавелевокислого натрия. По достижении полноты осаждения в фильтрате определяют РВ. В противном случае опыт повторяют с большим количеством раствора щавелевокислого натрия . [14]
После охлаждения до комнатной температуры содержимое стакана количественно переносят в мерную колбу вместимостью 200мл, прибавляя воду доводят объем раствора до метки, перемешивают и фильтруют через складчатый бумажны фильтр. Пипеткой отмеривают 50 мл полученного фильтрата, переносят его в мерную колбу вместимостью 100мл, прибавляют 10 мл насыщенного раствора щавелевокислого натрия и объем раствора доводят дистиллированной водой до метки. Раствор перемешивают и фильтруют через плотный или двойной фильтр. В фильтрате определяют полноту осаждения свинца, прибавляя несколько капель раствора щавелевокислого натрия к 1 — 3 мл фильтрата. Если образуется белый осадок, значит полнота осаждения свинца не достигнута. Опыт повторяют с большим количеством щавелевокислого натрия для осаждения свинца из 50 мл фильтрата после первого осаждения. Избыток щавелевокислого натрия в растворе пробы не влияет на определение редуцирующих Сахаров. Образовавшийся осадок отфильтровывают через плотный фильтр и в фильтрате определяют редуцирующие сахара эбулиостатическим методом по первому варианту. [15]
Источник
Приготовление стандартного раствора щавелевой кислоты (или оксалата натрия)
Аналитические демпферные весы с разновесами.
Мерные колбы, Vном. = 200 или 250 мл.
Бюксы для взвешивания.
Промывалки с дистиллированной водой.
Химические воронки 40-50 мм.
Стаканчики под слив.
Первичным стандартом в перманганатометрии является оксалат натрия или щавелевая кислота.
Взаимодействие перманганата со щавелевой кислотой в кислой среде выражается уравнением:
Рассчитаем, какую навеску щавелевой кислоты надо взять, чтобы приготовить 250 мл раствора с C (1/2 H2C2O42H2O) = 0,0200 моль/л.
Из уравнения реакции следует, что при окислении пернанганатом один ион оксалата отдает два электрона, следовательно, молярная масса эквивалента щавелевой кислоты рассчитывается следующим образом:
Для приготовления 250 мл раствора щавелевой кислоты с молярной концентрацией эквивалента, равной 0,0200 моль/л, надо взять навеску щавелевой кислоты массой: m (H2C2O42H2O) = 0,0200 0,250 63,04 = 0,3150 г.
Практически поступают следующим образом: на аналитических весах в бюксе взвешивают навеску близкую к 0,3150 г. С помощью воронки ее количественно переносят в мерную колбу емкостью 250 мл, растворяют в небольшом объеме дистиллированной воды и доводят объем раствора в колбе до метки дистиллированной водой. Полученный раствор перемешивают в течение 2-3 минут. Из соотношения взятой и теоретической навесок рассчитывают молярную концентрацию эквивалента приготовленного раствора щавелевой кислоты.
Например, взяли навеску щавелевой кислоты не точно теоретическую, а несколько меньшую, допустим 0,3102 г. Следовательно, молярная концентрация эквивалента раствора щавелевой кислоты не будет равна 0,0200 моль/л. Вычисляют молярную концентрацию эквивалента этого раствора: C(1/2 H2C2O42H2O) = 0,3102 / (63,04 0,25) = 0,0197 моль/л.
II. Стандартизация раствора перманганата калия
Мерные колбы, Vном. = 200 или 250 мл.
Мерные пипетки, Vном. = 10 мл.
Мерные пипетки, 5 мл.
Мерные бюретки, 0-25 мл.
Промывалки с дистиллированной водой.
Конические колбы для титрования.
Химические воронки 40-50 мм.
Стаканчики под слив.
Раствор KMnO4 неизвестной концентрации.
Раствор серной кислоты с C(1/2 H2SO4) = 2 моль/л.
Раствор щавелевой кислоты (или оксалата натрия) известной концентрации.
В колбу для титрования помещают пипеткой 10 мл приготовленного раствора щавелевой кислоты, добавляют 5 мл раствора серной кислоты с C(1/2 H2SO4) = 2 моль/л и нагревают до 80-90С.
Раствором перманганата калия заполняют бюретку. Уровень раствора устанавливают на нулевом делении (смотрят по нижнему мениску). При титровании первые порции раствора перманганата медленно добавляют к анализируемому раствору по 3-4 капли при перемешивании. Скорость реакции между перманганатом калия и щавелевой кислотой вначале очень небольшая, но образующиеся в процессе титрования ионы марганца (II) оказывают каталитическое действие на скорость реакции. Поэтому при дальнейшем титровании раствор перманганата можно добавлять по 0,5-1 мл и перемешивать. Каждую порцию раствора перманганата следует добавлять только после исчезновения в титруемом растворе розовой окраски. В конце титрования раствор перманганата добавляют по каплям. При титровании необходимо следить за тем, чтобы титруемый раствор был горячим, так как нагревание ускоряет реакцию. Однако нагревание раствора до кипения недопустимо, так как при этом щавелевая кислота разлагается по схеме:
Для определения конечной точки титрования в перманганатометрии пользуются следующим обстоятельством. Если определяемый восстановитель прореагировал еще не полностью, и реакция не закончилась, то прибавляемый перманганат обесцвечивается. Как только весь восстановитель прореагирует полностью, окраска перманганата не исчезает. По прекращению обесцвечивания перманганата и появлению окрашивания исследуемого раствора в розовый цвет судят о завершении реакции. Следовательно, в перманганатометрии индикатором является сам перманганат. В данном случае последняя порция перманганата идет не на восстановление ионов оксалата, а на окрашивание титруемого раствора в розовый цвет. Это лишнее, пошедшее не на титрование, а на окрашивание раствора количество перманганата можно учесть «глухим опытом».
С этой целью в колбу для титрования помещают 5 мл раствора серной кислоты с C(1/2 H2SO4) = 2 моль/л и добавляют такое количество дистиллированной воды, чтобы объем раствора в «глухом опыте» был приблизительно равен объему анализируемого раствора в конце титрования. К этому раствору по каплям добавляют раствор перманганата калия до тех пор, пока интенсивность окраски оттитрованного раствора и раствора «глухого опыта» не сравняются. Объем раствора, создающего окраску в «глухом опыте» (число капель, умноженное на объем капли), вычитают из объема раствора перманганата, пошедшего на титрование анализируемого раствора. Таким образом, находят объем раствора перманганата, который требуется только для окисления взятого количества щавелевой кислоты. Молярная концентрация эквивалента раствора перманганата определяется из уравнения:
где: C(1/2 H2C2O4 2H2O) – молярная концентрация эквивалента раствора щавелевой кислоты, моль/л;
V(H2C2O4) – объем раствора щавелевой кислоты, взятый на титрование, мл;
V(KMnO4) — объем раствора перманганата калия, пошедший на титрование раствора щавелевой кислоты за вычетом объема, израсходованного на создание окраски в «глухом опыте», мл.
Источник
Натрий щавелевокислый насыщенный раствор как приготовить
Методы приготовления вспомогательных реактивов и растворов, применяемых при анализе
Reagents. Methods for preparation of accessory reagents and solutions used for analysis
____________________________________________________________________
Текст Сравнения ГОСТ4517-87 с ГОСТ 4517-2016 см. по ссылке.
— Примечание изготовителя базы данных.
____________________________________________________________________
Дата введения 1988-07-01
1. РАЗРАБОТАН И ВНЕСЕН Министерством химической промышленности
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 29.10.87 N 4093
3. Стандарт полностью соответствует стандарту СЭВ 435-86
5. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка
2.7.1; 2.22.1; 2.51.1; 2.73.1; 2.82.1; 2.140.1; 2.141.1; 2.158.1
6. ПЕРЕИЗДАНИЕ. Май 2008 г.
Настоящий стандарт распространяется на реактивы и устанавливает методы приготовления вспомогательных реактивов, растворов и смесей, применяемых при анализе химических реактивов.
1. ОБЩИЕ УКАЗАНИЯ
1.1. При приготовлении растворов следует соблюдать требования ГОСТ 27025.
1.2. При приготовлении растворов применяют мерную лабораторную стеклянную посуду (цилиндры, мензурки, колбы, пробирки) по ГОСТ 1770;
стеклянные холодильники по ГОСТ 25336;
тигли, чашки, стаканы, воронки, пробирки из прозрачного кварцевого стекла по ГОСТ 19908;
чашки, тигли фарфоровые, стаканы фарфоровые, воронки Бюхнера (фарфоровые) по ГОСТ 9147;
фильтровальную лабораторную бумагу по ГОСТ 12026;
посуду и оборудование лабораторные стеклянные по ГОСТ 25336;
ареометры общего назначения для измерения плотности жидкости;
весы лабораторные общего назначения по ГОСТ 24104*.
* На территории Российской Федерации документ не действует. Действует ГОСТ Р 53228-2008. — Примечание изготовителя базы данных.
1.3. Для приготовления вспомогательных реактивов и растворов применяют реактивы, указанные в нормативно-технической документации (приложение 1).
1.4. Для приготовления растворов применяют реактивы квалификаций химически чистый и чистый для анализа.
При необходимости перед приготовлением растворов реактивы измельчают. Готовые растворы перемешивают и при наличии мути, осадка, хлопьев фильтруют. Фильтрацию проводят, если нет специальных указаний, через обеззоленный фильтр «синяя лента», промытый горячей водой.
1.5. При использовании растворов, хранившихся длительное время, следует убедиться в отсутствии опалесценции, осадка, хлопьев. В противном случае растворы фильтруют или заменяют свежеприготовленными.
1.6. Растворы реактивов хранят в стеклянной посуде с притертыми пробками или в полиэтиленовых флаконах с навинчивающимися крышками при температуре 15-25 °С (если нет других указаний).
1.7. Работу с огнеопасными, взрывоопасными, ядовитыми и летучими веществами проводят в соответствии с требованиями безопасности.
2. ПРИГОТОВЛЕНИЕ ВСПОМОГАТЕЛЬНЫХ РЕАКТИВОВ И РАСТВОРОВ
2.1. Альдегид салициловый, раствор с массовой долей приблизительно 1% в метаноле
0,10 г салицилового альдегида растворяют в 10,0 см метанола.
Раствор хранят в темном прохладном месте в течение 6 мес. Следует применять только бесцветный раствор.
2.2. Алюминон, раствор с массовой долей приблизительно 0,1%
0,10 г алюминона (C H N O ) растворяют в 100 см воды.
2.3. Амальгама цинка (для восстановления)
2.3.1. Реактивы и растворы
Кислота серная, раствор с массовой долей 5%.
Цинк металлический гранулированный.
Около 3 г цинка нагревают в течение 10 мин на водяной бане в фарфоровой чашке со 100 г ртути и с 3-5 см раствора серной кислоты и затем охлаждают. Амальгаму тщательно промывают водой и в делительной воронке отделяют от твердых кусков сплава ртути и цинка.
Амальгаму цинка готовят под тягой.
Оставшийся в делительной воронке твердый конгломерат цинка и ртути сохраняют, затем снова используют, периодически прибавляя его к отработанной амальгаме.
2.4. Аммиак водный, раствор с массовой долей 10%
425 см водного аммиака с массовой долей 25% и плотностью 0,907 г/см разбавляют водой до 1 дм .
Плотность полученного раствора аммиака с массовой долей 10% — 0,960 г/см . Раствор хранят в полиэтиленовой посуде.
2.5. Аммиак водный, раствор с массовой долей 25%, не содержащий углекислоты
2.5.1. Приготовление из газообразного аммиака
2.5.1.1. Реактивы и растворы
Аммиак (из баллона).
Вода дистиллированная, не содержащая углекислоты; готовят в соответствии с п.2.38.
Натрия гидроксид (натрия гидроокись), раствор с массовой долей 50%; готовят в соответствии с п.2.102.
Раствор готовят насыщением воды, не содержащей углекислоты, газообразным аммиаком на установке, описание которой приведено в приложении 2. Насыщение аммиаком продолжают до получения раствора плотностью 0,907 г/см , что соответствует раствору с массовой долей аммиака 25%. Для получения раствора более высокой концентрации приемник с раствором охлаждают водой со льдом.
2.5.2. Приготовление из водного аммиака
2.5.2.1. Реактивы и растворы
Аммиак водный, раствор с массовой долей 25%.
Вода дистиллированная, не содержащая углекислоты; готовят в соответствии с п.2.38.
Кальция оксид (кальция окись).
500 см водного аммиака помещают в круглодонную колбу вместимостью 1 дм и осторожно прибавляют кашицу, полученную из 10 г оксида кальция и воды, непосредственно перед прибавлением ее к раствору аммиака. Колбу соединяют с вертикально поставленным холодильником, верхний конец которого закрывают трубкой с натронной известью, и оставляют раствор на 18-20 ч. Затем отгоняют аммиак на установке, описание которой приведено в приложении 3, поглощая его водой, не содержащей углекислоты. Насыщение продолжают до получения в приемнике раствора плотностью 0,907 г/см , что соответствует раствору с массовой долей аммиака 25%. Для получения раствора более высокой концентрации приемник с раствором охлаждают водой со льдом.
2.6. Аммония ацетат, раствор с массовой долей 10%
10,0 г ацетата аммония (CH COONH ) растворяют в 90 см воды.
Источник