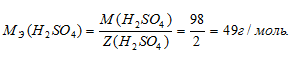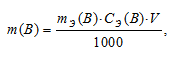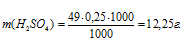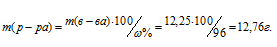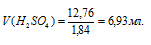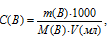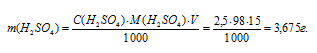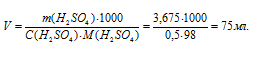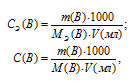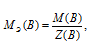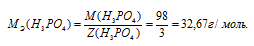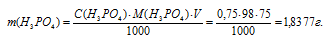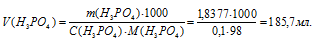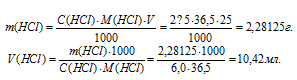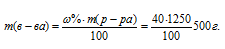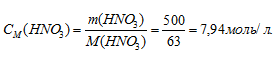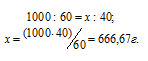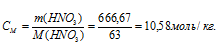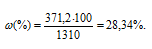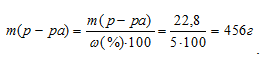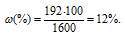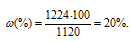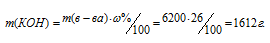Решение задач по химии на приготовление раствора определенной нормальности
Задача 421.
Сколько миллилитров 96%-ного (по массе) раствора H2SO4 (р = 1,84 г/мл) нужно взять для приготовления 1л 0,25 н. раствора?
Решение:
Определим молярную массу эквивалента H2SO4 из соотношения:
где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Рассчитаем массу H2SO4 в 1л 0,25 н раствора по формуле:
m(B) — масса вещества; mЭ(В) — молярная масса эквивалента вещества, г; СЭ(В) — эквива-лентная концентрация или нормальность; V — объём раствора.
Теперь рассчитаем массу раствора, если известны массовая доля H2SO4 (96%) и масса H2SO4 (12,25 г) по формуле:
w(%) — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Определим объём раствора H2SO4, необходимого для приготовления 1 л 0,25 н раствора по формуле: m = pV, где p — плотность раствора, V — объём раствора.
Ответ: 6,93 мл.
Задача 422.
Сколько миллилитров 0,5 М раствора H 2SO 4 можно приготовить из 15 мл 2,5 М раствора?
Решение:
Для нахождения массы серной кислоты, содержащейся в 15 мл 2,5 М раствора, можно определить по формуле:
С(В) – молярная концентрация вещества (В), m(B) – масса растворённого вещества (В), М(В) – молярная масса вещества (В), V – объём раствора.
По этому же уравнению рассчитаем объём раствора, который можно приготовить из 3,675 г H 2SO 4:
Ответ: 75мл.
Задача 423.
Какой объем 0,1 М раствора H3PO4 можно приготовить из 75 мл 0,75 н. раствора?
Решение:
Для решения задачи используем формулы:
где
СЭ(В) – молярная концентрация эквивалента вещества (В);
С(В) — молярная концентрация вещества (В);
МЭ(В) – молярная масса эквивалента вещества (В);
M(B) — молярная масса вещества (В);
m(B) – масса растворённого вещества (В);
V(мл) – объём раствора.
МЭ(В) — молярная масса эквивалента кислоты, г/моль; М(В) — молярная масса кислоты; Z(В) — эквивалентное число; Z(кислоты) равно числу ионов H + в H3PO4 → 3.
Рассчитаем массу ортофосфорной кислоты:
Определим объём раствора H3PO4, необходимого для приготовления раствора:
Ответ: 185,7мл.
Задача 424.
Какой объем 6,0М раствора НСI нужно взять для приготовления 25 мл 2,5М раствора НСI?
Решение:
Для нахождения массы соляной кислоты, содержащейся в 25 мл 2,5 М раствора, а также объёма 6,0 М раствора можно использовать формулу:
С(В) — молярная концентрация вещества (В);
M(B) — молярная масса вещества (В);
m(B) – масса растворённого вещества (В);
V(мл) – объём раствора.
Ответ: 10,42мл.
Задача 425.
Плотность 40%-ного (по массе) раствора HNO3 равна 1,2 5г/мл. Рассчитать молярность и моляльность этого раствора.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Массу HNO3, содержащуюся в 1 литре раствора, рассчитаем по формуле:
где

Молярную концентрацию раствора (CM) получим делением числа граммов HNO3 в 1 л раствора на молярную массу HCl (36,5 г/моль):
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000 г растворителя.
Находим, сколько граммов HNO3 приходится на 1000 г воды, составив пропорцию:
Ответ: 7,94 моль/л; 10б=,58 моль/л.
Задача 426.
Вычислить массовую долю гидроксида натрия в 9,28 н. растворе NaOН (р = 1,310г/мл).
Решение:
Найдём массу NaOН, содержащуюся в 1000 мл раствора из пропорции:
Масса 1 литра раствора NaOН (р = 1,310 г/мл) равна 1310 г (1000 . 1,310 = 1310).
Массовую долю гидроксида натрия вычислим по формуле:
где

Источник
Получение 5%-ного раствора серной кислоты
Задача 401.
Какой объем воды надо прибавить к 100 мл 20%-ного (по массе) раствора H2SO4 ( p = 1,14 г/мл), чтобы получить 5%-ный раствор?
Решение:
Масса 100 мл 20%-ного раствора H2SO4 равна 100 . 1,14 = 114 г. В этом растворе содержится 20% H2SO4, т.е. 22,8г (114 . 0,2 = 22,8). По условию задачи эта масса составляет 5% от общей массы разбавленного раствора. Тогда масса полученного раствора может быть рассчитана по уравнению:
где

Следовательно, к исходному раствору необходимо прилить 342г воды (456 – 114 = 342).
Ответ: 342г.
Задача 402.
К 500 мл 32%-ной (по массе) HNO3 (р = 1,20 г/мл) прибавили 1л воды. Чему равна массовая доля HNO3 в полученном растворе?
Решение:
Массу раствора рассчитаем по формуле: m(р-ра) = pV, где m(р-ра) — масса раствора, p — плотность раствора,
V- объём раствора.
Находим массу раствора HNO3: m(р-ра) — 1,2 . 500 = 600. Находим массу растворённого HNO3:
m(HNO3) = 600 . 0,32 = 192 г. Масса раствора после смешения составляет 1600 г (600 + 1000 = 1600).
Массовую долю в полученном раствора находим из формулы:
где

Ответ: 12%.
Задача 403.
До какого объема надо разбавить 500 мл 20%-ного (по массе) раствора NaCl (p = 1,152 г/мл), чтобы получить 4,5%-ный раствор (p = 1,029 г/мл)?
Решение:
Находим массу 500 мл 20%-ного раствора NaCl: m(р-ра) = 115,2 . 500 = 576 г. Масса NaCl, содержащаяся в 576 г этого раствора, составляет 115,2г (576 . 0,20 = 115,2). Массу раствора NaCl, содержащуюся в растворе с массовой долей 4,5% рассчитаем, используя формулу:содержащуюся в растворе с массовой долей 4,5% рассчитаем, используя формулу:
где

Объём раствора находим по формуле: m(р-ра) = pV, где m(р-ра) — масса раствора, p — плотность раствора,
V — объём раствора.
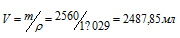
Ответ: 2,49 л.
Задача 404.
Найти массовую долю азотной кислоты в растворе, в 1л которого содержится 224г HNO3 (p = 1,12 г/мл).
Решение:
Находим массу 1л азотной кислоты по формуле: m(р-ра) = p . V, где m(р-ра) — масса раствора, p — плотность раствора, V — объём раствора.
m(HNO3) = 1,12 . 1000 = 1120 г.
Для расчета массовой доли используем формулу:
где

Ответ: 20%.
Задача 405.
Плотность 26%-ного (по массе) раствора КОН равна 1,24 г/мл. Сколько молей КОН находится в 5л раствора?Решение:
Находим массу 5л раствора КОН по формуле: m(р-ра) = pV, где m(р-ра) — масса раствора, p — плотность раствора, V — объём раствора.
m(КОН) = 1,24 . 5000 = 6200 г.
Для расчета массы КОН используем формулу:
где

М(КОН)=56 г/моль. Следовательно, количество КОН можно рассчитать:
Источник
Необходимо приготовить раствор серной кислоты объемом 100 см3 с массовой
Посмотрим в стандартную табличку тепловых значений:
CuO + 2HCl = CuCl2 + H2O + 63,6 кДж
Далее составим пропорцию:
80 г. (CuO) — 63,6 кДж
100 г. (CuO) — x кДж => x = 79,5 кДж.
Ответ: Q(CuO) на 100 г. = 79,5 кДж.
Какой объем 0,1 н. раствора серной кислоты необходимо отмерить для приготовления 100 мл 0,02 н. раствора?
Решение. Т.к. количество молей эквивалентов H2SO4 в исходном и приготовленном растворах одинаково, то, в соответствии с законом эквивалентов (7), объем исходного раствора фото
Плотность водного раствора NaCl = 1095,0 г/л. Определить массовую долю соли в растворе, рассчитать молярную долю NaCl, молярную концентрацию, молярную концентрацию эквивалента соли, моляльную концентрацию и массовую концентрацию раствора.
Решение. Для определения массовой доли соли в растворе используем данные табл.3 Приложения. Т.к. заданное значение плотности раствора NaCl в табл.3 отсутствует, применяем метод интерполяции. Для этого используем ближайшие меньшее и большее значения плотностей и соответствующие им массовые доли раствора данной соли. Считая, что в указанных пределах зависимость между плотностью и массовой долей раствора линейная, рассчитаем массовую долю растворенного вещества в растворе по пропорции (индекс б означает «большее», м — «меньшее»)
Источник
Получение 5%-ного раствора серной кислоты
Задача 401.
Какой объем воды надо прибавить к 100 мл 20%-ного (по массе) раствора H2SO4 ( p = 1,14 г/мл), чтобы получить 5%-ный раствор?
Решение:
Масса 100 мл 20%-ного раствора H2SO4 равна 100 . 1,14 = 114 г. В этом растворе содержится 20% H2SO4, т.е. 22,8г (114 . 0,2 = 22,8). По условию задачи эта масса составляет 5% от общей массы разбавленного раствора. Тогда масса полученного раствора может быть рассчитана по уравнению:
где

Следовательно, к исходному раствору необходимо прилить 342г воды (456 – 114 = 342).
Ответ: 342г.
Задача 402.
К 500 мл 32%-ной (по массе) HNO3 (р = 1,20 г/мл) прибавили 1л воды. Чему равна массовая доля HNO3 в полученном растворе?
Решение:
Массу раствора рассчитаем по формуле: m(р-ра) = pV, где m(р-ра) — масса раствора, p — плотность раствора,
V- объём раствора.
Находим массу раствора HNO3: m(р-ра) — 1,2 . 500 = 600. Находим массу растворённого HNO3:
m(HNO3) = 600 . 0,32 = 192 г. Масса раствора после смешения составляет 1600 г (600 + 1000 = 1600).
Массовую долю в полученном раствора находим из формулы:
где

Ответ: 12%.
Задача 403.
До какого объема надо разбавить 500 мл 20%-ного (по массе) раствора NaCl (p = 1,152 г/мл), чтобы получить 4,5%-ный раствор (p = 1,029 г/мл)?
Решение:
Находим массу 500 мл 20%-ного раствора NaCl: m(р-ра) = 115,2 . 500 = 576 г. Масса NaCl, содержащаяся в 576 г этого раствора, составляет 115,2г (576 . 0,20 = 115,2). Массу раствора NaCl, содержащуюся в растворе с массовой долей 4,5% рассчитаем, используя формулу:содержащуюся в растворе с массовой долей 4,5% рассчитаем, используя формулу:
где

Объём раствора находим по формуле: m(р-ра) = pV, где m(р-ра) — масса раствора, p — плотность раствора,
V — объём раствора.
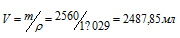
Ответ: 2,49 л.
Задача 404.
Найти массовую долю азотной кислоты в растворе, в 1л которого содержится 224г HNO3 (p = 1,12 г/мл).
Решение:
Находим массу 1л азотной кислоты по формуле: m(р-ра) = p . V, где m(р-ра) — масса раствора, p — плотность раствора, V — объём раствора.
m(HNO3) = 1,12 . 1000 = 1120 г.
Для расчета массовой доли используем формулу:
где

Ответ: 20%.
Задача 405.
Плотность 26%-ного (по массе) раствора КОН равна 1,24 г/мл. Сколько молей КОН находится в 5л раствора?Решение:
Находим массу 5л раствора КОН по формуле: m(р-ра) = pV, где m(р-ра) — масса раствора, p — плотность раствора, V — объём раствора.
m(КОН) = 1,24 . 5000 = 6200 г.
Для расчета массы КОН используем формулу:
где

М(КОН)=56 г/моль. Следовательно, количество КОН можно рассчитать:
Источник