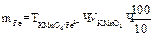§ 94. Приготовление и хранение раствора KMnO4
Титрование перманганатом проводят без индикатора. Поскольку одна капля раствора KMnO4 даже при концентрации его, равной 0,01 н., окрашивает в конце титрования 50 мл раствора в отчетливый розовый цвет, нет надобности употреблять 0,1 н. растворы перманганата. Обычно применяют его 0,02—0,05 н. растворы.
Перманганат всегда содержит примеси продуктов восстановления, например МпОг. Кроме того, он легко разлагается под влиянием восстановителей — аммиака, органических веществ, попадающих в воду с пылью, и т. п. Вследствие этого концентрация раствора KMnO4 в первое время после приготовления несколько уменьшается.
Отсюда следует, что приготовить титрованный раствор перманганата по точной навеске нельзя. Титр его необходимо устанавливать не ранее чем через 7—10 дней после приготовления раствора *.
Для того чтобы раствор KMnO4 был достаточно устойчивым и титр его не изменялся, осадок MnO2, присутствовавший в нем в качестве примеси, а также образовавшийся в результате окисления перманганатом органических веществ и аммиака, которые содержатся в воде, необходимо удалить, так как он каталитически ускоряет разложение KMnO4. Нужно также помнить, что перман-ганат окисляет резину, корковые пробки, бумагу и другие вещества, поэтому необходимо избегать соприкосновения раствора с ними. Так, нельзя фильтровать раствор KMnO4 через бумажные чрильтры, а необходимо пользоваться стеклянными фильтрующими тиглями или сливать раствор с осадка MnO2 сифоном.
Хранить раствор перманганата нужно в темноте или в склянках из темного стекла, так как свет ускоряет разложение KMnO4: 4MnOJ+ 2H2O —> 4MnO2^ + 4OH- + ZO^
Для приготовления раствора KMnO4 берут на технических весах навеску, требуемую для получения 1 л 0,02 н. раствора. Она равна 0,02-31,61 г, т. е. около 0,63 г. Далее отмеряют большим мерным цилиндром 1 л дистиллированной воды для растворения навески. Так как кристаллы KMnO4 растворяются довольно медленно, часть взятой воды нагревают почти до кипения и небольшими порциями ее обрабатывают при тщательном перемешивании лавески KMnO4 в стакане или колбе. Время от времени осторож-ло сливают жидкость с кристаллов в другой сосуд, заменяя ее яовой порцией горячей воды. Приготовленный охлажденный раствор переливают в склянку емкостью 1 л, добавляют туда же оставшуюся воду и, тщательно перемешав, оставляют на 7— 10 дней. Склянку закрывают пробкой и хранят в темноте (лучше готовить раствор в склянке из темного стекла). По истечении этого времени сифоном осторожно сливают жидкость с осевших хлопьев MnO2 (или профильтровывают через стеклянный фильтрующий тигель).
Источник
Приготовление рабочего раствора перманганата калия.
Приготовить титрованный раствор перманганата калия по точной навеске нельзя, т.к. при растворении KMnO4 в дистиллированной воде происходит частичное восстановление его в MnO2. Поэтому концентрация раствора KMnO4 в первые дни после его приготовления изменяется. Поэтому титр раствора устанавливают через 7-10 дней после его приготовления по исходному веществу-щавелевой кислоте: Н2С2О4 •2Н2О. Для приготовления 1л 0,05н раствора KMnO4 берут навеску:
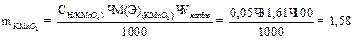
Взятую навеску переносят в мерную колбу на 1 л, растворяют в дистиллированной воде и оставляют стоять 7-10 дней, а затем фильтруют через стеклянный фильтр в другую склянку из темного стекла.
Приготовление рабочего раствора щавелевой кислоты.
Щавелевая кислота реагирует с перманганатом калия в кислой среде по уравнению:
Молярная масса эквивалента щавелевой кислоты равна:
М(э) Н2С2О4 •2Н2О= 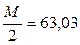
1. для приготовления 100 мл 0,05 н раствора щавелевой кислоты берут навеску :
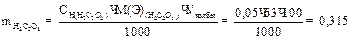
2. взятие навески: масса бюкса с веществом —————-г
масса пустого бюкса —————-г
3. навеску щавелевой кислоты переносят в мерную колбу на 100 мл, растворяют в дистиллированной воде, доводят объем водой до метки.
4. нормальную концентрацию щавелевой кислоты вычисляют по формуле:

Установка молярной концентрации эквивалента, нормальной концентрации (титра) раствора перманганата калия.
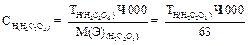
1.Бюретку, предварительно ополоснув приготовленным раствором KMnO4, заполняют этим раствором.
2.Отбирают аликвотную часть (пипеткой 10 мл) раствора щавелевой кислоты и переносят в коническую колбу для титрования, добавляют 10 мл 2н раствора H2SO4 и нагревают до 60-70 о С. Нагревание необходимо для ускорения взаимодействия MnO4 — c С2О4 2- . Горячий раствор медленно титруют из бюретки по каплям раствором KMnO4 до появления неисчезающей бледно-розовой окраски. Объемы раствора KMnO4 отсчитывают по верхнему краю мениска.
Результаты трех титрований заносят в тетрадь.
Нормальную концентрацию раствора KMnO4 вычисляют по формуле:
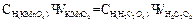
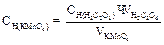
КОНТРОЛЬНАЯ ЗАДАЧА
Определение содержания железа (II) в соли Мора.
Определение эквивалентного железа основано на окислении его перманганатом калия в кислой среде по реакции:
10 5 Fe 2+ -ẽ→Fe 3+
Определение железа проводят в растворе двойной соли сульфата железа-аммония (соли Мора) (NH4)2•Fe(SO4)2•6H2O являющейся более устойчивой к действию кислорода воздуха, чем FeSO4•7H2O.
1. полученный в мерной колбе раствор соли Мора доводят водой до метки.
2. отбирают аликвотную часть (10,0 мл) пипеткой, переносят в коническую колбу для титрования, добавляют мерным цилиндром 10 мл 2 н раствора. Заполняют бюретку стандартизированным раствором KMnO4.
3. исследуемый раствор титруют на холоде (18-25 о С), т.к. при повышении температуры скорость окисления Fe 2+ кислородом воздуха сильно возрастает. Хлориды мешают перманганатометрическому определению, вследствие возникновения сопряженной реакции окисления ионов С1 — перманганатом,это вызывает дополнительный расход KMnO4, и результаты титрования получаются неточными. Титрование проводят до появления бледно-розовой окраски, не исчезающей в течении 1-2 мин. Результаты трех титрований заносят в тетрадь:
V Fe 2+ , мл V KMnO4,мл
Вычисление граммового содержания железа в 100 мл раствора соли Мора.
1 способ: 1) вычисление нормальной концентрации раствора соли Мора:

2) вычисление граммового содержания:
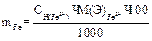
2 способ: 1) вычисление титра раствора KMnO4:
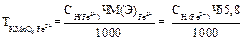
2) вычисление граммового содержания железа в 100 мл раствора соли Мора:
1.4.2 Лабораторная работа № 4.
ИОДОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ (ИОДОМЕТРИЯ)
Иодометрия представляет собой метод титриметрического анализа, основанного на использовании обратимого окислительно-восстановительного процесса, протекающего по схеме:
Нормальный окислительно-восстановительный потенциал равен +0,54 в. Поэтому более сильные окислители окисляют ион I — до свободного иода I2, а окислительно-восстановительные пары с меньшими окислительными потенциалами способны восстанавливать свободный иод до ионов иодида. Следовательно, иодометрия может применяться для определения восстановителей:Na2S2O3, H2SO3, H2S и для определения окислителей: KMnO4, K2Cr2O7, Cl2, Br2.
Рабочим раствором является раствор свободного иода, окисляющего восстановителя по схеме:
Определение восстановителей производят или непосредственным титрованием рабочим раствором иода, или способом обратного титрования. Для этого к определенному объему восстановителя добавляют в избытке определенный объем титрованного раствора иода, а затем избыток иода оттитровывают вторым рабочим раствором-тиосульфатом натрия.
Титрование растворами свободного иода проводят в кислой или нейтральной среде, т.к. при рН=8 протекает побочная реакция.
Определять окислителей прямым титрованием раствором иодида калия нельзя, т.к. в точке эквивалентности прекращается выделение свободного иода, но этот момент зафиксировать визуально невозможно.
Иодометрические определения окислителей производят не прямым, а косвенным методом ( метод замещения).
К раствору, содержащему сильную кислоту (H2SO4, HCl), приливают избыток КI и точный отмеренный объем раствора определяемого окислителя. При этом выделяется эквивалентное окислительное количество иода:
Выделившейся иод титруют раствором восстановителя-тиосульфатом натрия, который является вторым раствором в иодометрии.
Определяемый окислитель замещается эквивалентным количеством другого окислителя-иода, который и титруется раствором восстановителя-тиосульфата. Этот прием «косвенного» определения называется методом замещения, что значительно расширяет область применения объемного анализа.
Титрование проводится на холоде, т.к иод –вещество летучее. При титровании окислителей необходимо добавлять большой избыток, что ускорит реакцию, кроме того, избыток KI необходим для растворения выделившегося иода KI+I2→K[I3], т.к.в воде иод плохо растворяется. Комплексная соль разлагается при титровании иода тиосульфатом натрия. Реакция между иодидом калия и окислителем протекает во времени . Титрование выделившегося иода следует начинать через 5 мин после прибавления окислителя. Эквивалентная точка в иодометрии определяется с помощью индикатора –раствора крахмала. Чувствительность крахмала к водному раствору иода очень большая( одна капля 0, 0001н раствора I2 вызывает появление синего окрашивания в 50 мл раствора, содержащего крахмал) и еще более увеличивается в присутствии KI. Крахмал образует адсорбционное соединение синего цвета в присутствии полииодидиона [I3 — ]. Крахмал добавляют к раствору в конце титрования, когда почти весь иод оттитрован. При титровании восстановителей раствором иода крахмал приливают с самого начала.
Источник
2.3.4. Окислительно-восстановительного титрования
2.3.4.5. Приготовление и стандартизация рабочего раствора
В качестве рабочего раствора в методе перманганатометрии применяют 0,05 моль/л или 0,1 моль/л раствор KMnO4. Даже очень разбавленные растворы перманганата калия интенсивно окрашены. Поэтому фиксируют точку эквивалентности по появлению розовой окраски раствора, вызываемой добавлением лишь одной капли избытка стандартного раствора KMnO4. Его титр нельзя рассчитать по весу растворенного перманганата. Это связано с тем, что продажные препараты KMnO4 относительно высокой чистоты содержат следы хлоридов, нитратов, сульфатов (перманганата в них 99,0-99,6 % масс.). Однако перекристаллизацией из водного раствора можно получить продукт, содержащий 99,6-99,8 % масс. KMnO4. Но даже если взять его точную навеску для приготовления титрованного раствора, то концентрация оказывается несколько меньшей, чем это следовало бы по расчету. Оказывается, что даже в дистиллированной воде хорошего качества обычно присутствуют малые количества восстановителей. Поэтому лучше всего для приготовления стандартного раствора перманганата растворить несколько большее количество KMnO4, чем это требовалось бы по расчету, прокипятить раствор, охладить, а затем устанавливать его титр.
Для приготовления 1 л раствора перманганата калия с молярной концентрацией эквивалента 0,1 моль/л взвешивают на технических весах 3,16 г KMnO4 (если титрование проводят в кислой среде, то M1/5(KMnO4) = M(KMnO4)/5), раствор нагревают до кипения, дают ему постоять не менее двух недель для того, чтобы завершились все возможные окислительно-восстановительные реакции и полностью прошло осаждение образующегося при этом MnO2. Выдержанный раствор сливают через сифон (раствор можно фильтровать через асбестовую сетку или стеклянный фильтр, но ни в коем случае не через бумажный) и сохраняют в тщательно промытых темных бутылях, так как свет ускоряет разложение KMnO4:
Применяемая для хранения перманганата склянка должна быть снабжена притертой пробкой с целью защиты от соприкосновения с парами веществ, имеющих свойства восстановителей, от пыли, а также с целью исключения его испарения. Притертую пробку предварительно обрабатывают хромовой смесью для удаления органических веществ, а затем дистиллированной водой.
Готовый раствор не должен образовывать при хранении бурый налет двуокиси марганца на стенках посуды, так как его присутствие катализирует процесс дальнейшего разложения перманганата:
Количество двуокиси марганца в этом процессе возрастает, и поэтому действие ее — автокаталитическое. Действие ионов Mn 2+ такое же, так как эти ионы образуют с перманганатом водную двуокись марганца.
Лучший способ приготовления 0,01 М раствора KMnO4 состоит в разбавлении более концентрированного раствора водой, освобожденной от присутствия восстановителей путем перегонки в присутствии перманганата.
Титр раствора KMnO4 с течением времени несколько изменяется, поэтому его необходимо периодически проверять.
Титр раствора KMnO4 устанавливают по щавелевой кислоте H2C2O4 · 2H2O, оксалату аммония (NH4)2C2O4 · H2O, оксалату натрия Na2C2O4, мышьяковистому ангидриду As2O3, гексацианоферрату (II) калия K4[Fe(CN)6] · 3H2O, по металлическому железу, по соли Мора FeSO4 · (NH4)2SO4 · 6H2O, по йодиду калия KI, йодату калия KIO3 и некоторым другим веществам.
Наиболее часто в качестве установочных веществ используются щавелевая кислота и ее соли, так как они легко могут быть очищены от примесей перекристаллизацией из воды. Более удобно пользоваться оксалатом аммония или натрия, концентрация которых не изменяется во времени. Оксалат натрия не содержит кристаллизационной воды и устойчив, но, к сожалению, относительно труднорастворим.
Источник