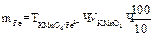§ 94. Приготовление и хранение раствора KMnO4
Титрование перманганатом проводят без индикатора. Поскольку одна капля раствора KMnO4 даже при концентрации его, равной 0,01 н., окрашивает в конце титрования 50 мл раствора в отчетливый розовый цвет, нет надобности употреблять 0,1 н. растворы перманганата. Обычно применяют его 0,02—0,05 н. растворы.
Перманганат всегда содержит примеси продуктов восстановления, например МпОг. Кроме того, он легко разлагается под влиянием восстановителей — аммиака, органических веществ, попадающих в воду с пылью, и т. п. Вследствие этого концентрация раствора KMnO4 в первое время после приготовления несколько уменьшается.
Отсюда следует, что приготовить титрованный раствор перманганата по точной навеске нельзя. Титр его необходимо устанавливать не ранее чем через 7—10 дней после приготовления раствора *.
Для того чтобы раствор KMnO4 был достаточно устойчивым и титр его не изменялся, осадок MnO2, присутствовавший в нем в качестве примеси, а также образовавшийся в результате окисления перманганатом органических веществ и аммиака, которые содержатся в воде, необходимо удалить, так как он каталитически ускоряет разложение KMnO4. Нужно также помнить, что перман-ганат окисляет резину, корковые пробки, бумагу и другие вещества, поэтому необходимо избегать соприкосновения раствора с ними. Так, нельзя фильтровать раствор KMnO4 через бумажные чрильтры, а необходимо пользоваться стеклянными фильтрующими тиглями или сливать раствор с осадка MnO2 сифоном.
Хранить раствор перманганата нужно в темноте или в склянках из темного стекла, так как свет ускоряет разложение KMnO4: 4MnOJ+ 2H2O —> 4MnO2^ + 4OH- + ZO^
Для приготовления раствора KMnO4 берут на технических весах навеску, требуемую для получения 1 л 0,02 н. раствора. Она равна 0,02-31,61 г, т. е. около 0,63 г. Далее отмеряют большим мерным цилиндром 1 л дистиллированной воды для растворения навески. Так как кристаллы KMnO4 растворяются довольно медленно, часть взятой воды нагревают почти до кипения и небольшими порциями ее обрабатывают при тщательном перемешивании лавески KMnO4 в стакане или колбе. Время от времени осторож-ло сливают жидкость с кристаллов в другой сосуд, заменяя ее яовой порцией горячей воды. Приготовленный охлажденный раствор переливают в склянку емкостью 1 л, добавляют туда же оставшуюся воду и, тщательно перемешав, оставляют на 7— 10 дней. Склянку закрывают пробкой и хранят в темноте (лучше готовить раствор в склянке из темного стекла). По истечении этого времени сифоном осторожно сливают жидкость с осевших хлопьев MnO2 (или профильтровывают через стеклянный фильтрующий тигель).
Источник
Приготовление рабочего раствора перманганата калия.
Приготовить титрованный раствор перманганата калия по точной навеске нельзя, т.к. при растворении KMnO4 в дистиллированной воде происходит частичное восстановление его в MnO2. Поэтому концентрация раствора KMnO4 в первые дни после его приготовления изменяется. Поэтому титр раствора устанавливают через 7-10 дней после его приготовления по исходному веществу-щавелевой кислоте: Н2С2О4 •2Н2О. Для приготовления 1л 0,05н раствора KMnO4 берут навеску:
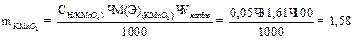
Взятую навеску переносят в мерную колбу на 1 л, растворяют в дистиллированной воде и оставляют стоять 7-10 дней, а затем фильтруют через стеклянный фильтр в другую склянку из темного стекла.
Приготовление рабочего раствора щавелевой кислоты.
Щавелевая кислота реагирует с перманганатом калия в кислой среде по уравнению:
Молярная масса эквивалента щавелевой кислоты равна:
М(э) Н2С2О4 •2Н2О= 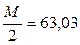
1. для приготовления 100 мл 0,05 н раствора щавелевой кислоты берут навеску :
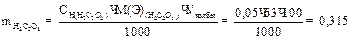
2. взятие навески: масса бюкса с веществом —————-г
масса пустого бюкса —————-г
3. навеску щавелевой кислоты переносят в мерную колбу на 100 мл, растворяют в дистиллированной воде, доводят объем водой до метки.
4. нормальную концентрацию щавелевой кислоты вычисляют по формуле:

Установка молярной концентрации эквивалента, нормальной концентрации (титра) раствора перманганата калия.
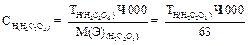
1.Бюретку, предварительно ополоснув приготовленным раствором KMnO4, заполняют этим раствором.
2.Отбирают аликвотную часть (пипеткой 10 мл) раствора щавелевой кислоты и переносят в коническую колбу для титрования, добавляют 10 мл 2н раствора H2SO4 и нагревают до 60-70 о С. Нагревание необходимо для ускорения взаимодействия MnO4 — c С2О4 2- . Горячий раствор медленно титруют из бюретки по каплям раствором KMnO4 до появления неисчезающей бледно-розовой окраски. Объемы раствора KMnO4 отсчитывают по верхнему краю мениска.
Результаты трех титрований заносят в тетрадь.
Нормальную концентрацию раствора KMnO4 вычисляют по формуле:
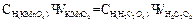
КОНТРОЛЬНАЯ ЗАДАЧА
Определение содержания железа (II) в соли Мора.
Определение эквивалентного железа основано на окислении его перманганатом калия в кислой среде по реакции:
10 5 Fe 2+ -ẽ→Fe 3+
Определение железа проводят в растворе двойной соли сульфата железа-аммония (соли Мора) (NH4)2•Fe(SO4)2•6H2O являющейся более устойчивой к действию кислорода воздуха, чем FeSO4•7H2O.
1. полученный в мерной колбе раствор соли Мора доводят водой до метки.
2. отбирают аликвотную часть (10,0 мл) пипеткой, переносят в коническую колбу для титрования, добавляют мерным цилиндром 10 мл 2 н раствора. Заполняют бюретку стандартизированным раствором KMnO4.
3. исследуемый раствор титруют на холоде (18-25 о С), т.к. при повышении температуры скорость окисления Fe 2+ кислородом воздуха сильно возрастает. Хлориды мешают перманганатометрическому определению, вследствие возникновения сопряженной реакции окисления ионов С1 — перманганатом,это вызывает дополнительный расход KMnO4, и результаты титрования получаются неточными. Титрование проводят до появления бледно-розовой окраски, не исчезающей в течении 1-2 мин. Результаты трех титрований заносят в тетрадь:
V Fe 2+ , мл V KMnO4,мл
Вычисление граммового содержания железа в 100 мл раствора соли Мора.
1 способ: 1) вычисление нормальной концентрации раствора соли Мора:

2) вычисление граммового содержания:
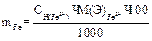
2 способ: 1) вычисление титра раствора KMnO4:
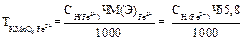
2) вычисление граммового содержания железа в 100 мл раствора соли Мора:
1.4.2 Лабораторная работа № 4.
ИОДОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ (ИОДОМЕТРИЯ)
Иодометрия представляет собой метод титриметрического анализа, основанного на использовании обратимого окислительно-восстановительного процесса, протекающего по схеме:
Нормальный окислительно-восстановительный потенциал равен +0,54 в. Поэтому более сильные окислители окисляют ион I — до свободного иода I2, а окислительно-восстановительные пары с меньшими окислительными потенциалами способны восстанавливать свободный иод до ионов иодида. Следовательно, иодометрия может применяться для определения восстановителей:Na2S2O3, H2SO3, H2S и для определения окислителей: KMnO4, K2Cr2O7, Cl2, Br2.
Рабочим раствором является раствор свободного иода, окисляющего восстановителя по схеме:
Определение восстановителей производят или непосредственным титрованием рабочим раствором иода, или способом обратного титрования. Для этого к определенному объему восстановителя добавляют в избытке определенный объем титрованного раствора иода, а затем избыток иода оттитровывают вторым рабочим раствором-тиосульфатом натрия.
Титрование растворами свободного иода проводят в кислой или нейтральной среде, т.к. при рН=8 протекает побочная реакция.
Определять окислителей прямым титрованием раствором иодида калия нельзя, т.к. в точке эквивалентности прекращается выделение свободного иода, но этот момент зафиксировать визуально невозможно.
Иодометрические определения окислителей производят не прямым, а косвенным методом ( метод замещения).
К раствору, содержащему сильную кислоту (H2SO4, HCl), приливают избыток КI и точный отмеренный объем раствора определяемого окислителя. При этом выделяется эквивалентное окислительное количество иода:
Выделившейся иод титруют раствором восстановителя-тиосульфатом натрия, который является вторым раствором в иодометрии.
Определяемый окислитель замещается эквивалентным количеством другого окислителя-иода, который и титруется раствором восстановителя-тиосульфата. Этот прием «косвенного» определения называется методом замещения, что значительно расширяет область применения объемного анализа.
Титрование проводится на холоде, т.к иод –вещество летучее. При титровании окислителей необходимо добавлять большой избыток, что ускорит реакцию, кроме того, избыток KI необходим для растворения выделившегося иода KI+I2→K[I3], т.к.в воде иод плохо растворяется. Комплексная соль разлагается при титровании иода тиосульфатом натрия. Реакция между иодидом калия и окислителем протекает во времени . Титрование выделившегося иода следует начинать через 5 мин после прибавления окислителя. Эквивалентная точка в иодометрии определяется с помощью индикатора –раствора крахмала. Чувствительность крахмала к водному раствору иода очень большая( одна капля 0, 0001н раствора I2 вызывает появление синего окрашивания в 50 мл раствора, содержащего крахмал) и еще более увеличивается в присутствии KI. Крахмал образует адсорбционное соединение синего цвета в присутствии полииодидиона [I3 — ]. Крахмал добавляют к раствору в конце титрования, когда почти весь иод оттитрован. При титровании восстановителей раствором иода крахмал приливают с самого начала.
Источник
Нужна помощь по аналитической химии, срочно.
1.навеска кальцинированной соды в 0,1267г. растворена в воде и оттитрована в присутствии метилового оранжевого 22,65 мл раствора HCl(K=1.02, 0.1н). Определить массовую долю Na2CO3 в образце.
2. Стандартизация раствора KMnO4: Почему нельзя приготовить раствор KMnО4 на точной навеске? Почему стандартизацию раствора KMnО4 проводят лишь через 7 дней после приготовления расвора? Напишите реакцию, происходящую при стандартизации раствора KMnО4 по щавелевой кислоте. Рассчитайте массу эквивалента KMnO4 и H2C2O4
105,99 х 0,1 х 1,02 х 22,65 х 100 / 2 х 1000 х 0,1267 = 96,63%
Перманганат калия, применяемый для приготовления рабочего раствора, обычно содержит ряд примесей, из которых наиболее значительными являются соединения Mn (IV). Кроме того, в первые дни после приготовления раствора происходит восстановление KMnO4 случайными примесями органических веществ, имеющихся в дистиллированной воде, в результате чего концентрация раствора KMnO4 при его хранении изменяется. Поэтому приготовить титрованный раствор по точной навеске нельзя.
Титр раствора KMnO4 определяют не ранее чем через 7–10 дней после его приготовления. За это время перманганат окислит все случайные примеси, содержащиеся в воде. Образовавшийся осадок MnO2 необходимо удалить, т. к. он каталитически ускоряет разложение KMnO4. После того как MnO2, осядет на дно сосуда, раствор KMnO4 осторожно сифоном сливают в другой, обернутый черной бумагой сосуд ( или темную склянку) . Хранят раствор в темноте, поскольку под действием света происходит его разложение.
http://stefan18.narod2.ru/36/
C2O4(2-) — 2e = 2CO2 Мэ = Мм/2
MnO4(-) + 8H(+) + 5e = Mn(2+) + 4H2O Мэ = Мм/5
5H2C2O4 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2 + 8h2O
Источник
Некоторые замечания о титровании и точных растворах
Установка титра—одна из ответственнейших операций лабораторной техники. От правильности приготовления титрованного раствора завиеит и результат анализа. Не нужно забывать, что, например, на заводе на основе данных анализа осуществляется контроль за течением технологического процесса и неправильный анализ может повести к тем или иным осложнениям. Так как каждый анализ почти всегда сопровождается титрованием, каждый работник лаборатории должен хорошо освоить технику проведения этой операции.
Нужно помнить несколько правил, относящихся к титрованным растворам.
1. Титрованные растворы должны быть по возможности свежими. Длительное хранение их не должно допускаться. Для каждого раствора есть свой предельный срок хранения.
2. Титрованные растворы при стоянии изменяют свой титр, поэтому их следует иногда проверять. Если же делают особенно ответственный анализ, проверка титра раствора обязательна.
3. Титрованные растворы, на которые действует свет -(растворы AgNO3 и др.), следует хранить в желтых бутылях или в таких, которые бы защищали раствор от действия света.
4. При приготовлении растворов марганцевокнслого калия титр их следует устанавливать не ранее чем через 3—4 дня после приготовления. То же относится ко всём другим растворам, способным изменяться со временем или при соприкосновении с воздухом, стеклом и пр.
5. Титрованные растворы щелочей лучше хранить в бутылях, покрытых внутри парафином, а также защищать их от действия двуокиси углерода воздуха (хлоркальциевая трубка с натронной известью или аска-ритом),
6. Все бутыли с титрованными растворами должны иметь четкую надпись с указанием вещества, нормальности, поправки, времени изготовления раствора и даты проверки титра.
7. При титровании кислых или щелочных растворов полезно применять так называемый раствор-свидетель.
Во время титрования колбу нужно держать левой рукой, а правой рукой управлять краном бюретки, давая стекать жидкости равномерно. При титровании очень большое значение имеет скорость его. Поэтому при повторном титровании одного и того же раствора нужно, чтобы скорость добавления раствора из бюретки была по возможности одинаковой, т. е. в одно и то же время вытекало бы определенное количество жидкости. Положение рук при титровании показано на рис. 352.
Для перемешивания титруемого раствора очень удобно»при-менять магнитные мешалки. В этом случае титрование можно вести как в обычной конической колбе, так и в специальных, приспособленных для титрования темиоокрашенных жидкостей.
При аналитических работах большое внимание нужно уделять расчетам. Они не будут казаться трудными, если с самого начала работы усвоить понятия, которые лежат в основе всех расчетов, т. е. понятия о титре, нормальности и грамм-эквиваленте и о связи между ними.
Например, если взята какая-нибудь навеска нужного вещества, то титр T приготовленного раствора будет равен навеске а, деленной на объем (V) раствора:

Рис. 352. Положение рук при титровании.
Нормальность можно вычислить, если известна навеска а и грамм-эквивалент E растворяемого вещества


Если же раствор готовят в другом объеме, меньшем или большем, чем 1000 мл, навеску рассчитывают на 1 л, и тогда формула для вычисления нормальности примет вид

Эта формула позволяет рассчитывать нормальность раствора из взятой навески независимо от его объема. Между титром, грамм-эквивалентом и нормальностью существует простая зависимость:

Иногда при расчетах пользуются поправкой на нормальность или коэффициент нормальности К. Эта поправка является отношением титра практического T к титру теоретическому (То):

Эта поправка показывает, какому количеству миллилитров точно нормального раствора соответствует 1 мл данного раствора. При умножении результатов титрования (мл) на эту поправку полученный объем приводят к определенной концентрации, например 0,1 н. раствору.
Однако целесообразность пользования поправкой на нормальность очень сомнительна, так как все расчеты можно с успехом делать и без этой поправки, только усложняющей расчет.
При работе с нормальными растворами задача всегда сводится вначале к определению нормальности неизвестного раствора, а затем к определению количества неизвестного вещества, содержащегося в растворе. Таким образом, основной расчетно-аналитической формулой при всех объемных определениях будет

т. е. произведение нормальности известного раствора на объем известного раствора при достижении конца реакции всегда равно произведению нормальности неизвестного раствора на объем последнего. Это произведение показывает число эквивалентов прореагировавших веществ. Отсюда можно определить нормальность неизвестного раствора A2, которая будет равна

(2)
Когда величина N2 известна, применяют общую формулу для определения нормальности по навеске (а);

(3)
Поскольку задачей аналитика является определение Величины а, из этой формулы находят;

(4)
Или, подставив значение N2 из формулы (2),получим:

Приведенные формулы позволяют проводить все расчеты без поправок на нормальность, так как принимается, что она может быть выражена любым целым или дробным числом. Главное во всяком расчете найти количество эквивалентов, при умножении которых на величину грамм-эквивалента всегда получится количество искомого вещества.
Пример. Пусть была взята навеска 0,5000 г руды, содержащей железо. После ее растворения и разбавления полученного раствора До 100 мл в мерной колбе для титрования методом пермангапато-метрии каждый раз берут по 10 мл анализируемого раствора.
Раствор KMnO4-0,0495 н. На титрование пошло: 11,2; 11,1; 11,0; 11,1 мл раствора KMnO4. Берем среднее 11,1 мл. Нормальность раствора 11,1 • 0,0495 = 10 * N2, откуда

Количество Fe в 100 мл раствора (грамм-эквивалент Fe в данном случае равен 55,85):

Чтобы выразить содержание железа в руде в процентах, правую часть равенства умножают на JOO и делят на взятую навеску руды, т. е.
Источник