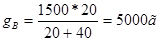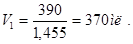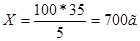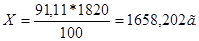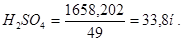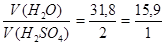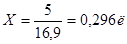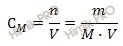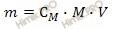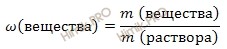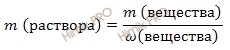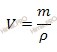Приготовление рабочего раствора кислот и щелочей из концентрированных растворов



Сколько мл. концентрированного раствора азотной кислоты удельного веса 1,400 потребуется для приготовления 500 мл, 1н.раствора ?
Решение: Рассчитываем вес кислоты по формуле (8):
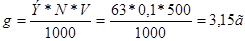
Находим по таблице процентное содержание НNO3 удельного веса 1,400 г/см 3 . Оно равно 66,97%
Далее расчет производится по пропорции:
100 г р-ра – 66,97 г HNO3
Можно этот же расчет производить по формуле:
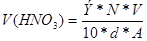
гдеV(HNO3) – нужное количество мл. концентрированной кислоты, d- ее плотность, А – процентная концентрация кислоты, V- объем приготовляемого раствора, мл.
3. При разбавлении растворов меняется его объем и концентрация, но общее количество грамм- эквивалентов остается постоянным. Следовательно, при разбавлении можно использовать уравнение (5).
Например, до какого объема нужно разбавить 100мл 2н. Раствора HNO3, чтобы концентрация кислоты стала равной 0,4н.
Т.е. нужно к раствору прилить 400 мл. H2O
4. Смешивание растворов. Чтобы вычислить соотношения, в которых следует взять два раствора известных концентраций, пользуются правилом “креста”. По этому правилу в центре пишут ту концентрацию, которую требуется получить (в%).
У концов линий слева пишутся концентрации исходных растворов, большая- сверху, меньшая- снизу. У концов линий креста справа пишут разность между концентрациями исходных растворов и требуемого раствора (разность меньшей концентрации и требуемой – вверху). Эта разность показывает, сколько следует взять весовых частей раствора большей концентрации. Разность большей концентрации и требуемой записывается справа внизу и показывает, сколько нужно взять раствора меньшей концентрации.
Пример1. В каком соотношении следует смешать 80%-ный раствор HCI с 10%, чтобы получить 30%-ный раствор?
Решение: По правилу «креста» находим
80 



следовательно, надо взять 20 весовых частей 80%-го раствора и прибавить к нему 50 весовых частей 10%-го раствора.
Пример2. Какие количества 80%-го и 20%-го растворов HNO3
Нужно взять, чтобы приготовить 1500г. 40%-го раствора?
Решение: Находим по правилу «креста» соотношение весовых частей:
80 


 |
40
20 
Следовательно соотношение весовых частей g ’ А:g’B = 20: 40. Количество 80%-го раствора определяется из соотношения:
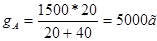
а количество 20%-го раствора можно найти из соотношения:
Пример3. Несколько иначе выглядит расчет разбавления или увеличения концентрации имеющегося раствора. Пусть требуется рассчитать, сколько 80%-ой серной кислоты надо добавить к 500г. 20%-ой кислоты, чтобы получить 60% раствор?
Решение: по правилу «креста»




т.е. на 20г. 20%-го раствора следует взять 40г. 80%-го раствора. Далее находим то количество 80%-ой кислоты, которое нужно добавить к 500г слабой кислоты, составив пропорцию:
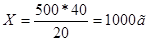
Пример 4. При приготовлении определенных объемов растворов необходимо учитывать плотность, чтобы переводить объемные единицы измерений в весовые.
Какие количества 10%-го и 80%-го растворов азотной кислоты нужно смешать, чтобы получить 1л 60%-го раствора?
Решение: по правилу креста
80 

10 

т.е. исходные растворы кислот нужно смешивать в соотношении 20:50.
По справочнику находим, что плотность 60%-го раствора HNO3 составляет 1,365, поэтому 1л нужного нам раствора весит 1365г. Это количество раствора нужно разделить на две части в соотношении 20:50. Составляем пропорции:
Из 20г 10%-го раствора получим 20+50г р-ра
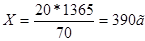
т.е. нужно взять 390г 10%-го раствора.
Аналогично: из 50г 80%-го раствора—————-70г
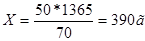
Для удобства пересчитывают эти количества в объеме на единицы. Для 10%-го раствора HNO3 плотность равна 1,455, поэтому объем раствора, необходимый для смешивания будет равен:
Для 60% -го раствора плотность равна 1,455, поэтому объем раствора равен:
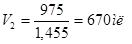
Пример 5. При решении задач на разбавление растворов чистым растворителем нужно второй раствор в правиле «креста» считать за раствор с концентрацией 0.
Сколько воды следует добавить к 100г 40%-ой щелочи натрия, чтобы получить 5%-ый раствор?
Решение: по правилу «креста»
40 



т.е. 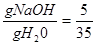
далее определяем количество воды, которое нужно смешать со 100г щелочи:

Пример 6. При решении задач на смешивание растворов, концентрации которых выражены в молях или нормальностях, моляльностях, также можно применять правило «креста».
Сколько нужно взять 0,2М и 1М растворов, чтобы приготовить 1000мл 0,4м раствора?
Решение: по правилу «креста»:
1 



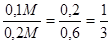
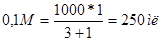
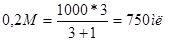
Пример 7.Сколько воды нужно добавить к 1000мл. 1,15н раствора NaOH, чтобы получить 1,0Н раствор?
Решение: по правилу «креста»




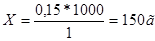
Пример 8. Сколько воды и серной кислоты, удельного веса 1,82 г/см 3 следует взять для приготовления 5л 2Н раствора?
Решение: Пересчитаем концентрацию серной кислоты на нормальность. По справочнику находим, что если плотность H2SO4 равна 1,82, то она содержит 91,11г. H2SO4 в 100г раствора.
В 100г раствора — 91,11г
В 1820г (1литр) — Х
Эквивалент H2SO4 = 49, поэтому нормальность будет равна:
Далее применяем правила «креста»:




т.е. отношение объемов
Из 1 литра H2SO4 плотностью 1,82 получается (15,9+1)л. раствора. Из Х – 5л. р-ра.
Из 15,9л. H2O получится 16,9л. 2Н р-ра
Источник
Химик.ПРО – решение задач по химии бесплатно
Какой объем раствора азотной кислоты (HNO3) концентрированного с массовой долей равной 60 % и плотностью раствора 1,37 г/см 3 необходимо взять для приготовления 800 см 3 раствора с молярной концентрацией вещества, равной 2 моль/л?
Решение задачи
Найдем сколько концентрированной азотной кислоты (HNO3) (в граммах) потребуется для приготовления 800 см 3 (или 0,8 л объем раствора азотной кислоты) раствора с молярной концентрацией 2 моль/л. Для расчета будем использовать формулу нахождения молярной концентрации раствора:
CM – молярная концентрация раствора;
n – химическое количество растворенного вещества;
M – молярная масса растворенного вещества;
m – масса растворенного вещества;
V – объем раствора азотной кислоты.
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
Из вышеуказанной формулы выразим и рассчитаем массу растворенного вещества:
Учитывая, что молярная масса азотной кислоты (HNO3) равна 63 г/моль (смотри таблицу Менделеева), получаем:
m (HNO3 (конц.)) = 2 моль/л ∙ 63 г/моль ∙ 0,8 л = 100,8 (г).
Используя формулу нахождения массовой доли растворенного вещества:
выразим массу раствора азотной кислоты (HNO3):
m (раствора HNO3 (конц.)) = 100,8 г/ 0,6 = 168 (г).
Если раствор 60-процентный, то массовая доля азотной кислоты (HNO3) в нем 0,6.
Вычислим объем раствора азотной кислоты (HNO3) концентрированного, который потребуется для приготовления 0,8 л раствора с молярной концентрацией 2 моль/л. Будем использовать формулу, устанавливающую связь между объемом раствора азотной кислоты и массой раствора:
Получаем, объем раствора азотной кислоты:
V (раствора HNO3 (конц.)) = 168 г /1,37 г/мл = 122,63 (мл).
Ответ:
объем раствора азотной кислоты концентрированного 122,63 миллилитра.
Источник