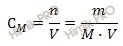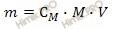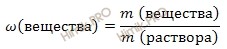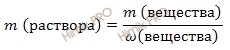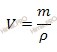Химик.ПРО – решение задач по химии бесплатно
Какой объем раствора азотной кислоты (HNO3) концентрированного с массовой долей равной 60 % и плотностью раствора 1,37 г/см 3 необходимо взять для приготовления 800 см 3 раствора с молярной концентрацией вещества, равной 2 моль/л?
Решение задачи
Найдем сколько концентрированной азотной кислоты (HNO3) (в граммах) потребуется для приготовления 800 см 3 (или 0,8 л объем раствора азотной кислоты) раствора с молярной концентрацией 2 моль/л. Для расчета будем использовать формулу нахождения молярной концентрации раствора:
CM – молярная концентрация раствора;
n – химическое количество растворенного вещества;
M – молярная масса растворенного вещества;
m – масса растворенного вещества;
V – объем раствора азотной кислоты.
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
Из вышеуказанной формулы выразим и рассчитаем массу растворенного вещества:
Учитывая, что молярная масса азотной кислоты (HNO3) равна 63 г/моль (смотри таблицу Менделеева), получаем:
m (HNO3 (конц.)) = 2 моль/л ∙ 63 г/моль ∙ 0,8 л = 100,8 (г).
Используя формулу нахождения массовой доли растворенного вещества:
выразим массу раствора азотной кислоты (HNO3):
m (раствора HNO3 (конц.)) = 100,8 г/ 0,6 = 168 (г).
Если раствор 60-процентный, то массовая доля азотной кислоты (HNO3) в нем 0,6.
Вычислим объем раствора азотной кислоты (HNO3) концентрированного, который потребуется для приготовления 0,8 л раствора с молярной концентрацией 2 моль/л. Будем использовать формулу, устанавливающую связь между объемом раствора азотной кислоты и массой раствора:
Получаем, объем раствора азотной кислоты:
V (раствора HNO3 (конц.)) = 168 г /1,37 г/мл = 122,63 (мл).
Ответ:
объем раствора азотной кислоты концентрированного 122,63 миллилитра.
Источник
Как приготовить 1М азотную кислоту?
Если можно то с расчетами пожалуйста.
Если смешать, как советовали, 1 моль чистой (100%-ной) азотной кислоты (это 63 г, 41,7 мл, ее концентрация 24 М) и 1 моль воды (18 мл), то концентрация полученного раствора не будет равна 1 М! Для получения 1 М раствора в 1 литре его должен содержаться 1 моль азотной кислоты. Для получения такого раствора необходимо знать концентрацию кислоты, которую вам нужно будет разбавлять. Без этого приготовить 1 М раствор невозможно. Кстати, 100%-ную азотную кислоту вы вряд ли достанете, и мало кто из химиков вообще ее видел. Продажная кислота имеет концентрация немногим больше 60%. Кислота с концентрацией 60 масс.% (или 13 М) имеет плотность 1,37. 1 М кислота довольно сильно разбавлена, поэтому можно считать, что ее плотность близка к 1. Это упрощает расчеты. Если есть концентрированная кислота с известной концентрацией, нужно рассчитать с помощью таблиц *в них приводится плотность растворов разной концентрации), в каком ее объеме будет 1 моль в расчете на чистую кислоту, вылить этот объем в мерную колбу на 1 л и разбавить чистой водой до метки.
Для того, чтобы приготовить 1М азотной кислоты, проще взять 1 моль азотной и 1 л воды.
Массу одного моля азотной можно рассчитать так:
63-это молекулярная и молярная масса азотной, если я не ошибаюсь, а 1- количество вещества.
Получается, надо в чистую колбу добавить 63 г азотной (с помощью весов определите, не забудьте вычесть вес емкости, в которой находится азотная), а затем добавить 1 л воды (можно измерить с помощью мерных цилиндров, например).
Если такой раствор занимает слишком много места, то просто переводите литры в мл, г в мг и считайте с ними.
Само понятие «кислота» можно разобрать с нескольких позиций.
Для начала рассмотрим на примерах школьных определений.
В 8 классе нам говорили что
Кислота это сложное вещество, молекулы которого состоятиз атомов водорода и кислотного остатка.
Ближе к концу 8 класса, а также в 11 классе нам говорили, что
Кислота это электролит, который при диссоциации образует катионы водорода и анионы кислотного остатка. Как правило кислотные остатки образуют элементы неметаллов.
Если же углубиться в этом вопросе, то можно рассмотреть это определение при помощи теории кислот и оснований. Для наглядности мы рассмотрим не только кислоты. Краткое изложение теории можно найти в таблице приложенной ниже.
H₂SO₄+ 2NaOH = Na₂SO₄+ 2H₂O
2H⁺ + SO₄²⁻ + 2Na⁺ + 2OH⁻ = 2Na⁺ + SO₄²⁻ + 2H₂O
HCl + KOH = KCl + H₂O
H⁺ + Cl⁻ + K⁺ + OH⁻ = K⁺ + Cl⁻ + H₂O
- Амфотерный гидроксид + Щелочь = Соль + H₂O
Zn(OH)₂ + 2NaOH = Na₂[Zn(OH)₄]
Zn(OH)₂ + 2Na⁺ + 2OH⁻ = 2Na⁺ + Zn(OH)₄²⁻
Zn(OH)₂ + 2OH⁻ = Zn(OH)₄²⁻
Cr(OH)₃ + 3KOH = K₃[Cr(OH)₆]
Cr(OH)₃ + 3K⁺ + 3OH⁻ = 3K⁺ + Cr(OH)₆³⁻
Cr(OH)₃ + 3OH⁻ = Cr(OH)₆³⁻
В настоящий момент это точно неизвестно из-за отсутствия способа измерения силы самых сильных кислот. Пока претендентов 3: смесь фтороводорода и пентафторида сурьмы (магическая кислота), которая имеет кислотность Гаммета около -20; и две карборановые кислоты — H(CHB11Cl11) и H(CHB11F11), которые протонируют все настолько сильно, что для них не удается подобрать инертный растворитель для измерения кислотности.
Вроде как сильнее H(CHB11F11). Она вытесняет водород из гексана, как и магическая кислота.
Источник
Приготовление раствора
Экспериментальная часть
Определение содержания тяжёлых металлов в пробах почв проводили согласно ПНД Ф 16.1:2:2.2.63-09 [12].
Все растворы готовят с использованием бидистиллированной (деионизованной) воды.
Раствор азотной кислоты, объемная доля 0,3%
В коническую колбу помещают 300-400 см 3 бидистиллированной (деионизованной) воды, осторожно, при перемешивании вливают 3см 3 концентрированной азотной кислоты квалификации оч.ч., доводят до 1000 см 3 бидистиллированной водой и перемешивают. Срок хранения в сосуде из полиэтилена, полипропилена или фторопласта не ограничен.
Раствор нитрата палладия, массовая концентрация 0,5 г/дм 3
В мерную колбу вместимостью 25 см 3 помещают 1,25 см 3 раствора исходного реактива (массовая концентрация 10 г/дм 3 ) и доводят до метки бидистиллированной водой.
Срок хранения в закрытом сосуде из полиэтилена , полипропилена или фторопласта в темном месте-6 месяцев.
Раствор нитрата магния, массовая концентрация 0,5 г/дм 3
В мерную колбу вместимостью 25 см 3 помещают 1,25 см 3 раствора исходного реактива (массовая концентрация 10 г/дм 3 ) и доводят до метки бидистиллированной (деионизованной ) водой. Срок хранения в закрытом сосуде из полиэтилена ,полипропилена или фторопласта в темном месте-6 месяцев.
Приготовление раствора азотной кислоты молярной концентрации 5 моль/дм 3
В стакан из термостойкого стекла помещают 400-500 см 3 бидистиллированной воды, приливают 310 см 3 концентрированной азотной кислоты квалификации ос.ч., тщательно перемешивают стеклянной палочкой, а затем доводят объем бидистиллированной водой до 1000 см 3 .Срок хранения не ограничен.
Приготовление раствора азотной кислоты , объемное соотношение 1:1
100 см 3 концентрированной азотной кислоты разбавляют равным объемом бидистиллированной воды при перемешивании. Срок хранения не ограничен.
Приготовление рабочих растворов элементов массовой концентрации 100 мг/дм 3
В мерную колбу вместимостью 50 см 3 помещают при помощи пипетки 5 см 3 государственного стандартного образца состава раствора соответсвующего иона, доводят до метки раствором азотной кислоты объемной доли 0,3% и перемешивают. Раствор устойчив при хранение в полиэтиленовой, пропиленовой или фторопластовой посуде в течение 3 месяцев.
Приготовление рабочих растворов элементов массовой концентрации 1мг/дм 3
В мерную колбу вместимостью 100 см 3 помещают при помощи пипетки 1см 3 рабочего раствора соответствующего иона массовой концентрации 100 мг/дм 3 ,доводят до метки раствором азотной кислоты объемной доли 0,3% и перемешивают. Раствор устойчив при хранении в полиэтиленовой ,полипропиленовой или фторопластовой посуде в течение 1 недели.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Приготовление растворов кислот



Лабораторная работа (10 неделя)
Теоретическая часть.
1) Молярная концентрация определяется количеством молей (грамм-молекул) вещества в 1 л раствора. Молярной концентрацией раствора (СМ) называют отношение количества растворенного вещества в молях (ν) к определенному объему этого раствора (V).
2) Молярная концентрация эквивалента (нормальная концентрация) определяется числом эквивалентов растворенного вещества в 1 л раствора.
Эквивалент — это реальная или условная частица вещества, которая может замещать, присоединять или быть каким либо другим образом эквивалентна одному иону водорода в кислотно основных реакциях, или одному электрону в окислительно-восстановительных реакциях.
Эквивалентная масса кислоты равна ее молярной массе, деленной на основность кислоты (количество протонов, т.е. количество ионов водорода):
Э кислоты = Mr (кислоты)/количество водорода
Так, для азотной кислоты HNO3 эквивалентная масса равна ее молярной массе. Для серной кислоты эквивалентная масса равна 98:2 = 49. Для трехосновной фосфорной кислоты эквивалентная масса равна 98:3 = 32,6. Таким способом вычисляется эквивалентная масса для реакций полного обмена или полной нейтрализации.
При реакциях неполной нейтрализации и неполного обмена эквивалентная масса вещества зависит от течения реакции. Например, в реакции:
1 моль фосфорной кислоты вступает в реакцию с 1 молем гидроксида натрия. Отсюда следует, что 1 моль гидроксида натрия эквивалентен в данной реакции 1 моль кислоты.
1 моль фосфорной кислоты вступает в реакцию с 2 молями гидроксида натрия. Отсюда следует, что 1 моль гидроксида натрия эквивалентен в данной реакции 1/2 моль кислоты.
1 моль фосфорной кислоты вступает в реакцию с 3 молями гидроксида натрия. Отсюда следует, что 1 моль гидроксида натрия эквивалентен в данной реакции 1/3 моль кислоты.
Эквивалентная масса основания равна его молярной массе, деленной на число гидроксильных групп.
Э основания = Mr (основания)/количество ОН —
Например, эквивалентная масса гидроксида натрия NaOH равна его молярной массе, а эквивалентная масса гидроксида магния Mg(OH)2 равна 58,32:2 =29,16 г. Так вычисляется эквивалентная масса только для реакции полной нейтрализации. Для реакции неполной нейтрализации эта величина также будет зависеть от течения реакции.
Эквивалентная масса соли равна молярной массе соли, деленной на произведение валентности металла на число его атомов в молекуле соли
Эсоли = Mr (соли)/суммарный заряд катионов, участвующих в реакции (произведение валентности металла на число атомов металла)
Так эквивалентная масса сульфата натрия равна 142: (1х2) = 71 г., а эквивалентная масса сульфата алюминия Аl2(SO4)3 равна 342: (3х2) = 57 г. Однако если соль участвует в реакции неполного обмена, то учитывается только число атомов металла, участвующих в реакции.
Практическая часть.
Алгоритм приготовления растворов молярной концентрации соли:
Необходимо приготовить 1 литр 0,25 М раствора карбоната натрия (Na2CO3):
1) Рассчитываем молярную массу соединения
2) См=m/Mr; m=Cм*Mr=0,25*106=26,5 г
3) Навеску карбоната натрия 26,5 г, взвешенную на весах, помещаем в мерную колбу вместимостью 1 литр (дм 3 ). Растворяем навеску, доводим до метки дистиллированной водой и перемешиваем.
Примечание: Если требуется меньший или больший объём раствора нормальной или молярной концентрации, пропорцией можно пересчитать навеску или объём.
Например, для приготовления 1 литра мы рассчитали навеску 26,5 г, а для 0,5 литров:
1 л ________26,5 г
0,5 л ______ Х г, Х=(0,5*26,5)/1=13,25 г
1 л _______26,5 г
2 л _______Х г, Х=(2*26,5)/1=53 г
Алгоритм приготовления растворов нормальной концентрации соли:
Необходимо приготовить 1 литр 0,25 Н раствора карбоната натрия (Na2CO3):
1) Рассчитываем эквивалентную массу соединения
2) Сн=m/Э; m=Cн*Э=0,25*53=13,25 г
3) Навеску карбоната натрия 13,25 г, взвешенную на весах, помещаем в мерную колбу вместимостью 1 литр (дм 3 ). Растворяем навеску, доводим до метки дистиллированной водой и перемешиваем.

Алгоритм приготовления растворов молярной концентрации основания:
Необходимо приготовить 1 литр 0,05 М раствора гидроксида кальция (Ca(OH)2)
1) Рассчитываем молярную массу соединения
2) См=m/Mr; m=Cм*Mr=0,05*74=3,7 г
3) Навеску гидрооксида кальция 3,7 г, взвешенную на весах, помещаем в мерную колбу вместимостью 1 литр (дм 3 ). Растворяем навеску, доводим до метки дистиллированной водой и перемешиваем. Щелочи растворяются в воде с выделением тепла, перед доведением раствора до метки, нужно дождаться его охлаждения.
Алгоритм приготовления растворов нормальной концентрации основания:
Необходимо приготовить 1 литр 0,1 Н раствора гидроксида кальция (Ca(OH)2)
1) Рассчитываем эквивалентную массу соединения
2) Сн=m/Э; m=Cн*Э=0,1*37= 3,7 г
3) Навеску гидрооксида кальция 3,7 г, взвешенную на весах, помещаем в мерную колбу вместимостью 1 литр (дм 3 ). Растворяем навеску, доводим до метки дистиллированной водой и перемешиваем. Щелочи растворяются в воде с выделением тепла, перед доведением раствора до метки, нужно дождаться его охлаждения.
Из расчетов видно, что навеска для приготовления 0,1 Н и 0,05 М раствора гидрооксида кальция одинакова. Можно сказать, что эти растворы готовятся одинаково.
Приготовление растворов кислот
Растворы кислот готовят, учитывая содержание основного вещества и его плотность, для пересчета массы в объём.
Алгоритм приготовления растворов молярной концентрации кислот:
Необходимо приготовить 1 литр 2 М раствора серной кислоты из концентрированной (H2SO4)
1) Рассчитываем молярную массу соединения
2) Измеряем плотность исходного раствора. Примем плотность 1,830 г/см 3 . При этой плотности содержание серной кислоты составляет 93,64 % (из справочника).
3) См=m/Mr; m=Cм*Mr=2*98=196 г
4) Расчет массы кислоты с учетом процентного содержания:
Так как кислота не 100 %, нужно пересчитать массу 93,64 % кислоты, которая будет содержать 196 г H2SO4
100 % * 196 г= 93,64 % * Х г,
Х = 100*196/93,64=209,31 г
5) Рассчитываем объём кислоты:
6) Объём серной кислоты 114,4 мл, отмеренный цилиндром, наливают тонкой струйкой в термостойкий стакан, содержащий 300-400 мл дистиллированной воды. Реакция идет с выделением тепла поэтому раствор охлаждаем, переводим количественно в мерную колбу вместимостью 1 литр(дм 3 ). Доводим до метки дистиллированной водой и перемешиваем.
Примечание: Для приготовления меньшего или большего количества раствора, составив пропорцию можно пересчитать и объём:
1 л ______114,4 мл
0,25 л ______ Х мл, Х=(0,25*114,4)/1=28,6 мл
Алгоритм приготовления растворов нормальной концентрации кислот:
Необходимо приготовить 1 литр 2 Н раствора серной кислоты из концентрированной (H2SO4)
1) Рассчитываем эквивалентную массу соединения
2) Измеряем плотность раствора. Примем плотность 1,830 г/см 3 . При этой плотности содержание серной кислоты составляет 93,64 % (из справочника).
3) Сн=m/Э; m=Cн*Э=2*49=98 г
4) Расчет массы кислоты с учетом процентного содержания:
Так как кислота не 100 %, нужно пересчитать массу 93,64 % кислоты, которая будет содержать 98 г H2SO4
100 % * 98 г= 93,64 % * Х г,
Х = 100*98/93,64=104,66 г
5) Рассчитываем объём кислоты:
6) Объём серной кислоты 57,2 мл, отмеренный цилиндром, наливают тонкой струйкой в термостойкий стакан, содержащий 300-400 мл дистиллированной воды. Реакция идет с выделением тепла, поэтому раствор охлаждаем, переводим количественно в мерную колбу вместимостью 1 литр (дм 3 ). Доводим до метки дистиллированной водой и перемешиваем.
При работе с серной кислотой следует быть осторожным, так как попадая на открытые участки кожи она вызывает химические ожоги, а при попытке смыть ее, кислота, реагируя с водой обжигает еще больше. Поэтому следует одевать защитные очки и использовать печатки, рукава халата должны быть заправлены в перчатки.
Источник