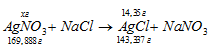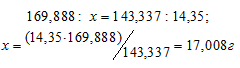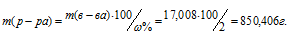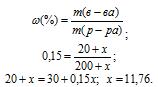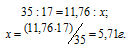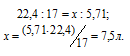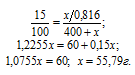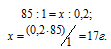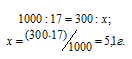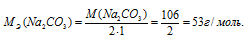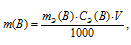Рассчеты, связанные с приготовлением растворов
Задача 411.
Сколько граммов 2%-ного (по массе) раствора AgNO3 дадут при взаимодействии с избытком NaCl 14,35г осадка?
Решение:
М(AgNO3) = 169,888г/моль; М(AgCl) = 143,337г/моль.
Уравнение реакции имеет вид:
Рассчитаем массу AgNO3, необходимую для получения 14,35г AgCl из пропорции:
Массу 2%-ного раствора AgNO3 рассчитаем по уравнению:

где

Отсюда масса раствора равна:
Ответ: 850,406г.
Задача 412.
Сколько литров NH3 (объем измерен при нормальных условиях) следует растворить в 200 г 10%-ного (по массе) раствора NH4OH, чтобы получить 15%-ный раствор NH4OH?
Решение:
Масса NH4OH в 200г 10%-ного раствора составляет 20г (200 . 0,1 = 20). Обозначим массу NH4OH, который следует растворить в 200г 10%-ного раствора NH4OH, чтобы получить 15%-ный раствор его через х.
Для расчёта массы NH4OH используем формулу:
где

m(NH4OH) = 20 + x; m() = 200 + x; 
Отсюда находим x по формуле:
Массу NH3, содержащуюся в11,76г NH4OH находим из пропорции:
Согласно закону Авогадро 1 моль любого газа при нормальных условиях занимает объём равный 22,4л. Объём, который занимает NH3 массой 5,71г, находим из пропорции:
Ответ: 7,5л.
Задача 413.
Сколько граммов SO3 надо растворить в 400г Н2О, чтобы получить 15%-ный (по массе) раствор Н2SO4?
Решение:
В молекуле Н2SO4 масса SO3 и Н2SO4 связаны друг с другом соотношением:
M(SO3) = 
где


Обозначим массу SO3 через х, а массу Н2SO4, соответственно, можно обозначить как x/0,816, массу полученного раствора – как (400 + х).
Для расчета х используем формулу:

где

Ответ: 55,79г.
Задача 414.
Найти массу NaNO3, необходимую для приготовления 300 мл 0,2М раствора.
Решение:
М(NaNO3) = 85г/моль. Массу NaNO3, содержащуюся в 0,2 М находим из пропорции:
Массу NaNO3, необходимую для приготовления 300мл 0,2 М раствора находим из пропорции:
Ответ: 5,1г.
Задача 415.
Сколько граммов Na2CO3 содержится в 500 мл 0,25 н. раствора?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:
где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Массу соли Na2CO3, содержащуюся в 500мл 0,25н раствора, находим по формуле:
где
m(B) — масса вещества; MЭ(В) — молярная масса эквивалента вещества, г; CЭ(В) — эквивалентная концентрация или нормальность; V — объём раствора.
Источник
Практическая работа по неорганической химии «Приготовление растворов заданной концентрации» 11 класс
Раздел 1 ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
Тема 1.4 Вода. Растворы. Электролитическая диссоциация
Цель работы: освоить расчеты и методику приготовления растворов определенной концентрации; отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
1. Ознакомиться с техникой приготовления растворов;
2. Сформировать умение выполнять расчеты по вычислению концентрации растворов.
Растворы играют важную роль в живой и неживой природе, а также в науке и технике. Большинство физиологических процессов в организмах человека, животных и растений, различных промышленных процессов, биохимических процессов в почвах и т.п. протекают в растворах.
Раствор – это гомогенная многокомпонентная система, в которой одно вещество распределено в среде другого или других веществ. Растворы могут быть в газообразном, жидком и твердом агрегатных состояниях. Масса раствора может быть вычислена по формуле:
Для выражения состава раствора используют количественные характеристики растворов или концентрации. Существуют разные способы выражения концентрации растворов:
1. Массовая доля растворенного вещества ( w )
где m р.в — масса растворенного вещества,
m р-ра – масса раствора, г.
Массовая доля растворенного вещества, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора, (измеряется в %, поэтому ее называют процентная концентрация).
Массовая доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %).
2. Молярная концентрация (См)
где m – масса растворенного вещества, г;
М – молярная масса, г/моль;
V — объем раствора, мл.
Задание: приготовить 70 г раствора соли (из воды и NaCl ), массовая доля которого 20% или 0,2.
Сделать расчет и запомнить навыки приготовления растворов из демонстрации.
При решении задач с изменением концентрации растворов необходимо помнить, что характеристики (m, V, w и пр.) даны для разных растворов: исходного и полученного. Важно не перепутать эти характеристики между собой. Поэтому рекомендуется обозначать растворы цифрами 1,2,3 и ставить соответствующие индексы у величин. Например, масса первого раствора будет записана так: m 1р-ра , а массовая доля вещества во втором растворе: w 2 .
Если решение таких задач вызывает у вас трудности, то попытайтесь себе представить этот процесс (упаривание, разбавление, и пр.) с помощью схематичного рисунка.
Решение задач на упаривание растворов
При решении данного типа задач, следует помнить, что в большинстве случаев испаряется вода, и, следовательно, уменьшается масса полученного раствора. Масса вещества, как правило, остается неизменной.
Решение задач на концентрирование растворов (добавление вещества)
При решении таких задач важно понимать, что при добавлении вещества концентрация раствора увеличивается, то есть масса вещества в полученном растворе = масса вещества в исходном растворе + масса добавленного вещества.
Решение задач на разбавление растворов
При решении задач данного типа следует помнить, что масса растворенного вещества остается неизменной, изменяется лишь масса растворителя и, соответственно, масса всего раствора.
Вопросы для самоконтроля
1.Что такое раствор и из каких компонентов он состоит?
2.Как определить массу раствора, зная его плотность и объем?
3.Какие существуют способы выражения концентрации раствора?
4.Как определить массовую долю растворенного вещества и в каких единицах она выражается?
5.Какой раствор называется молярным?
1.Сколько граммов хлорида натрия требуется для приготовления раствора массой 300г с массовой долей NaCl 10%?
2.Сколько граммов карбоната калия содержится в 0,2М растворе объемом 250мл?
3. Какой объем газа образуется при взаимодействии 250г 30% раствора серной кислоты с цинком?
4. Определите молярную концентрацию раствора, в 3-х литрах которого содержится 27г Na2CO3.
5. Сколько граммов воды надо испарить из 800 г 15%-го раствора вещества, чтобы увеличить его массовую долю на 5%?
1.Сколько граммов хлорида бария требуется для приготовления раствора массой 500г с массовой долей ВаCl2 10%?
2. Сколько граммов карбоната натрия содержится в 0,5М растворе объемом 250мл?
3. Какой объем газа образуется при взаимодействии 500г 70% раствора серной кислоты с магнием?
4. Сколько граммов NaCl и воды нужно взять, чтобы приготовить 300г физиологического раствора, массовая доля соли в котором составляет 0,9%
5. К 200г 15-%-ного раствора хлорида натрия добавили 40 г воды. Определите массовую долю соли в полученном растворе.
1.Определите молярную концентрацию раствора, в 3-х литрах которого содержится 40г КNO3.
2. В 160г воды растворили 40г соли. Какова массовая доля соли в данном растворе?
3. Какой объем газа образуется при взаимодействии 40мл 2М раствора НСl с железом?
4. Определите молярную концентрацию раствора, полученного при растворении нитрата калия массой 21г в воде массой 200г, если плотность полученного раствора равна 1,10 г/мл.
5. Сколько граммов воды надо испарить из 250 г 7%-го раствора вещества, чтобы увеличить его массовую долю на 10%?
1. В 100г воды растворили 150г сахара. Вычислите массовую долю (в %) сахара в растворе.
2.Необходимо приготовить 2 л 0,1М водного раствора СuSO4.Какая масса медного купороса для этого потребуется.
3. Определите молярную концентрацию раствора, в 4-х литрах которого содержится 54г Na2CO3.
4. Вычислите какой объем водорода (н.у.) выделяется при взаимодействии 300 мл 10% соляной кислоты (пл. 1,04 г/мл) с магнием.
5. Сколько граммов воды надо испарить из 750 г 12%-го раствора вещества, чтобы увеличить его массовую долю на 2%?
1. Требуется приготовить раствор массой 320г с массовой долей хлорида калия 3%. Рассчитайте массу КСl и массу воды, которые необходимы для приготовления раствора.
2. Определите молярную концентрацию раствора, полученного при растворении нитрата натрия массой 12г в воде массой 400г, если плотность полученного раствора равна 1,12 г/мл.
3. Вычислите какой объем воды потребуется для разбавления 200мл 96% этилового спирта (пл.0,8г/мл), чтобы получить10% раствор.
4. Определите молярную концентрацию раствора, в 3-х литрах которого содержится 80г Al Cl3
5. К 250г 10-%-ного раствора хлорида натрия добавили 25 г воды. Определите массовую долю соли в полученном растворе.
1.Нитрат калия массой 30 г растворили в воде объемом 200 мл, плотность воды 1г/мл . Рассчитайте массовую долю соли в растворе.
2. Необходимо приготовить 2 л 0,1М водного раствора СuSO4.Какая масса сульфата меди для этого потребуется.
3. Определите молярную концентрацию раствора, в 2-х литрах которого содержится 60г FeCl3
4. Вычислите какой объем водорода (н.у.) выделяется при взаимодействии 100 мл 40% соляной кислоты (пл. 1,04 г/мл) с магнием.
5. К 100г 25-%-ного раствора хлорида натрия добавили 50 г воды. Определите массовую долю соли в полученном растворе.
1. В 150г воды растворили 15г сахара. Вычислите массовую долю (в %) сахара в растворе.
2.Необходимо приготовить 0,2л 0,5М водного раствора СuSO4. Какая масса сульфата меди для этого потребуется.
3 . Определите молярную концентрацию раствора, в 4-х литрах которого содержится 54г Na2CO3.
4. Вычислите какой объем водорода (н.у.) выделяется при взаимодействии 300 мл 10% соляной кислоты (пл. 1,04 г/мл) с магнием.
5. Сколько граммов воды надо испарить из 750 г 12%-го раствора вещества, чтобы увеличить его массовую долю на 2%?
1. Внимательно прочитайте раздел Краткие теоретические сведения.
2. Решите задачи предложенного варианта.
3. Оформите отчет.
Содержание отчета: укажите номер практической работы, тему, цель, решите задачи полученного варианта, используя теоретический материал. Сформулируйте и запишите вывод.
Критерии оценки практической работы
Оценка «5»: 5 задач решены верно или в логическом рассуждении и решении нет ошибок, все задачи решены рациональным способом.
Оценка «4»: 4 задачи решены верно или в логическом рассуждении и решении нет существенных ошибок, но задачи решены нерациональным способом или допущено не более двух несущественных ошибок.
Оценка «3»: 3 задачи решены верно или в логическом рассуждении нет существенных ошибок, но допущены существенная ошибка в математических расчетах.
Оценка «2»: решены только 2 задачи или имеются существенные ошибки в логическом рассуждении и в решении.
Оценка «1»: не приступил к практической части занятия
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Источник