Опыт № 1. Приготовление раствора хлорида натрия заданной концентрации разбавлением
Рассчитайте, какие объемы исходного раствора и воды необходимы для приготовления 100 мл раствора хлорида натрия заданной концентрации (пример расчета см. ниже). Отмерьте рассчитанный объем исходного раствора мерным цилиндром; последние порции исходного раствора прибавляйте по каплям из капельницы. Затем в этот же цилиндр долейте дистиллированной воды до метки 100 мл; последние порции воды прибавляйте по каплям из соответствующей капельницы. Уровень жидкости определите по нижнему краю мениска.
Полученный раствор слейте в коническую колбу и тщательно перемешайте круговыми движениями. Чтобы установить точную концентрацию приготовленного раствора, налейте его в мерный цилиндр и измерьте его плотность с помощью ареометра.
По измеренной плотности найдите процентную концентрацию хлорида натрия в растворе (см. табл. 1). В случае отклонения плотности полученного раствора, определенной ареометром, от табличного значения, используйте метод интерполяции. Составьте отчет по проделанной работе, включив в него:
— расчет и методику приготовления раствора;
— рисунки ареометра и использованной посуды (рис. 1-4);
— результат определения плотности и процентной концентрации (массовой доли) приготовленного раствора;
— сравнение полученного значения процентной концентрации раствора с заданной;
— в случае отклонения полученного значения процентной концентрации от заданной, выполните расчет абсолютной и относительной ошибки приготовления раствора по формулам:


— расчет молярной и нормальной концентрации полученного раствора;
Пример расчета.
Какие объемы воды и 18%-ного (по массе) раствора NaClнужно взять для приготовления 100 мл 5%-ного (по массе) раствора NaCl.
| Дано: | Решение: |
| w1 (NaCl) = 18% Vр-ра2= 100 мл w2 (NaCl) = 5% | 1. Найдем массу 100 мл 5%-ного раствора NaCl. Для этого по табл. 1 определим плотность 5%-ного раствора: ρр-ра2 = 1,034 г/см 3 . mр-ра2= ρр-ра2 * Vр-ра2= 1,034 г/мл ∙ 100 мл = 103,4 г |
| 2. Определим массу NaCl, содержащуюся в 103,4 г 5%-ного раствора. w2 (NaCl) = m2(NaCl)/ mр-ра2* 100%, следовательно, m2(NaCl) = mр-ра2* w2 (NaCl) / 100% = 103,4 г * 5% / 100%= = 5,17 г. | |
| 3. Найдем массу 18% раствора, содержащего 5,17 г NaCl. m1(NaCl) = m2(NaCl) = 5,17 г; w1 (NaCl) = m1(NaCl)/ mр-ра1* 100%, следовательно, mр—ра1= m1(NaCl) * 100% / w1 (NaCl) = = 5,17г*100 % / 18 % = 28,72 г. | |
| Найти: Vр-ра1= ? V(Н2О) = ? | 4. Рассчитаем объем 18% раствора, предварительно определив по табл. 1 плотность исходного раствора ρр-ра1=1,132 г/см 3 . Vр-ра1= mр-ра1/ ρр-ра1 = 28,72 г /1,132 г/мл ≈ 25,4 мл (расчет выполняем до второго знака после запятой и округляем до первого знака после запятой). |
| 5. Найдем объем воды, необходимый для приготовления 100 мл 5% раствора NaCl. V(Н2О) = Vр-ра2— Vр-ра1= 100-25,4 ≈ 74,6 мл. | |
| Ответ: для приготовления 100 мл 5% раствора NaClтребуется 25,4 мл 18% раствора NaClи 74,6 мл воды. |
Таблица 1 – Плотность водного раствора хлорида натрия при 20°С
| Концентрация, % | ||||||||||||||
| Плотность, г/см 3 | 1,005 | 1,013 | 1,020 | 1,027 | 1,034 | 1,041 | 1,049 | 1,056 | 1,063 | 1,071 | 1,086 | 1,101 | 1,116 | 1,132 |
Перечень вариантов лабораторной работы
| № варианта | Концентрация хлорида натрия, % | Контрольные вопросы | |
| В исходном растворе, w1 | заданная,w2 | Для специальностей химического профиля | Для специальностей нехимического профиля |
Контрольные вопросы и задачи
1. Сколько граммов хлорида аммония необходимо для приготовления 0,2 М раствора объемом 500 мл? Рассчитайте нормальность этого раствора.
2. Смешали 300 г 20 %-ного раствора и 500 г 40 %-ного раствора хлорида натрия. Чему равны массовая и мольная доли полученного раствора?
3. Какой объем 12 %-ного раствора гидроксида калия (r = 1,1 г/мл) можно приготовить из 2 л 44 %-ного раствора (r = 1,5 г/мл)? Рассчитайте нормальность и моляльность этого раствора.
4. Смешаны 800 мл 3 н раствора и 1,2 л 12 %-ного раствора гидроксида калия (r = 1,1 г/мл). Вычислите молярность и моляльность полученного раствора.
5. Сколько граммов 32 %-ного раствора азотной кислоты следует добавить к 600 г 80 %-ного раствора той же кислоты для получения 64 %-ного раствора?
6. К 1 л 25 % — ной азотной кислоты, плотность которой 1,173 г/см 3 , добавили 1 л воды. Вычислите массовую и мольную доли (%) азотной кислоты в полученном растворе.
7. Рассчитайте массовую долю растворенного вещества и молярную концентрацию эквивалента в 3 М растворе сернистой кислоты (r = 1,15 г/мл).
8. Рассчитайте молярность и нормальность раствора с массовой долей серной кислоты 20% (ρ = 1,15 г/мл).
9. В воде объемом 450 мл растворили 50 г гидроксида натрия. Плотность полученного раствора ρ = 1,05 г/мл. Рассчитайте массовую долю (%), молярность и нормальность полученного раствора.
10. Рассчитайте массовую долю растворенного вещества и молярную концентрацию эквивалента в 0,1 М растворе фосфата натрия (r = 1,01 г/мл).
11. Рассчитайте молярную концентрацию 0,6 н раствора нитрата бария.
12. Рассчитайте молярную концентрацию раствора, содержащего в 1 л 0,6 моль эквивалента нитрата меди (II).
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Источник
Химик.ПРО – решение задач по химии бесплатно
Сколько граммов поваренной соли (NaCl) и воды (H2O) требуется для приготовления 10 литров раствора хлорида натрия (NaCl) для засола огурцов, в котором массовая доля хлорида натрия (NaCl) составляет 3%?
Решение задачи
Данную задачу я предлагаю решить путем составления пропорции.

По условию задачи для того, чтобы приготовить 3-ех процентный раствор хлорида натрия (NaCl), необходимо 3 г соли хлорида натрия (NaCl) растворить в 100 мл воды (H2O).
Учитывая, что в 1 л содержится 1000 мл, следовательно, в 10 л содержится 10 000 мл, найдем, сколько г соли содержится в 10 000 мл воды (H2O). Составим пропорцию:
в 100 мл H2O содержится 3 г NaCl
в 10 000 мл H2O содержится 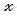
Следовательно, в 10 000 мл воды (H2O) содержится 300 г хлорида натрия (NaCl).
Вычислим массу воды (H2O), которую необходимо взять для приготовления раствора хлорида натрия (NaCl), по формуле, устанавливающей связь между массой раствора и растворителя:

Если плотность раствора хлорида натрия (NaCl) взять равной 1 г/мл, то масса раствора равна 10 000 г (рассчет производим по формуле, устанавливающей связь между массой и объемом раствора хлорида натрия (NaCl) m = ρ ∙ V)
m (H2O) = 10 000 – 300 = 9700 (г).
Ответ:
масса поваренной соли (NaCl) равна 300 грамм;
масса воды (H2O) равна 9700 грамм.
Источник
Приготовление растворов заданной концентрации



Цель работы:приготовить растворы заданной концентрации различными способами.
Оборудование и реактивы: аналитические весы, наборы разновесов, ареометр, стеклянные стаканы, мерный цилиндр, пипетка, резиновая груша, стеклянная палочка, дистиллированная вода, концентрированный раствор щёлочи NaOH, раствор хлорида натрия NaCl 2Н и 0,1Н, кристаллогидрат сульфата меди (II) СuSO4∙5H2O.
Раствор – гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другие растворимы в нём, это также система переменного состава, находящаяся в состоянии химического равновесия
Существует несколько способов классификации растворов. Так, основываясь на величине электрической проводимости, различают растворы электролитов и неэлектролитов. Можно классифицировать растворы по агрегатному состоянию системы и тех частиц, из которых она состоит.
Возможна классификация раствора по количеству растворенного вещества в нем присутствующего. Если молекулярные или ионные частицы, распределённые в жидком растворе, присутствуют в нём в таком количестве, что при данных условиях не происходит дальнейшего растворения вещества, раствор называется насыщенным. (Например, если поместить 50 г NaCl в 100 г H2O, то при 20ºC растворится только 36 г соли). Насыщенным называется раствор, который находится в динамическом равновесии с избытком растворённого вещества. Поместив в 100 г воды при 20ºC меньше 36 г NaCl мы получим ненасыщенный раствор. При нагревании смеси соли с водой до 100○C произойдёт растворение 39,8 г NaCl в 100 г воды. Если теперь удалить из раствора нерастворившуюся соль, а раствор осторожно охладить до 20ºC, избыточное количество соли не всегда выпадает в осадок. В этом случае мы имеем дело с перенасыщенным раствором. Перенасыщенные растворы очень неустойчивы. Помешивание, встряхивание, добавление крупинок соли может вызвать кристаллизацию избытка соли и переход в насыщенное устойчивое состояние.
Количественный состав раствора чаще всего выражается с помощью понятия «концентрации», под которым понимается содержание растворенного вещества (в определенных единицах) в единице массы или объема.
Договорились растворенное вещество обозначать через X, а растворитель — через S.
Чаще всего для выражения состава раствора используют массовую долю, молярную концентрацию (молярность) и мольную долю.
Массовая доля — это отношение массы растворенного вещества к общей массе раствора. Для бинарного раствора:

где ω(Х) — массовая доля растворенного вещества X; m(Х) масса растворенного вещества X, г; m(S) — масса растворителя S, г; m= [m(Х) + m(S)] — масса раствора, г.
Массовую долю выражают в долях единицы или в процентах (например: ω = 0,01 или ω = 1%).
Молярная концентрация (молярность) показывает число молей растворенного вещества, содержащегося в 1 литре раствора:
где С(Х) — молярная концентрация растворенного вещества X, моль/л; v(Х) — количество растворенного вещества X, моль; V — объем раствора, л.
Как следует из (2), молярная концентрация выражается в моль/л. Эта размерность иногда обозначается М, например: 2М NаОН.
Мольная доля растворенного вещества — безразмерная величина, равная отношению количества растворенного вещества к общему количеству веществ в растворе:

где N(Х) — мольная доля растворенного вещества X; v(Х) — количество растворенного вещества X, моль; v(S) — количество вещества растворителя S, моль.
Нетрудно представить, что сумма мольных долей растворенного вещества и растворителя равна 1:
При решении многих задач полезно переходить от молярной концентрации к массовой доле, мольной доле и т.д. Например, молярная и процентная концентрации взаимосвязаны так:
C(X) = 10 ∙ ω(X) ∙ ρ / M(X), (5)
ω(X) = C(X) ∙ M(X) / (10 ∙ ρ) (6)
где ω(Х) — массовая доля растворенного вещества, выраженная в %; М(Х) — молярная масса растворенного вещества, г/моль; р = m/(1000 V) — плотность раствора, г/мл.
Очень часто концентрацию насыщенного раствора, наряду с вышеперечисленными характеристиками, выражают через так называемый коэффициент растворимости или просто растворимость вещества.

Отношение массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя называют коэффициентом растворимости:
Растворимость вещества s показывает максимальную массу вещества, которая может раствориться в 100 г растворителя:
а) Приготовить разбавленный раствор соли:
Цель работы:приготовить 100 грамм 5% раствор безводного сульфата меди (II).
1) Для приготовления 5% раствора безводной соли сульфата меди (II) необходимо узнать массу кристаллогидрата сульфата меди (II) (так как безводной соли сульфата меди (II) нет), которую необходимо растворить в воде.
m(CuSO4) = 0.05∙100 = 5 (грамм)
n(CuSO4) = 5/160 = 0.03125 (моль), значит n(CuSO4∙5H2O) = 0.03125 (моль)
m(СuSO4∙5H2O) = 0.03125∙250 = 7.8125 (грамм) – необходимо взвесить на весах.
m(H2O) = 5∙18∙0.03125 = 2.8125 (грамм) – выделиться при растворении кристаллогидрата сульфата меди (II).
m(H2O) = 100-5-2.8125 = 92.1875 (грамм) – необходимо для приготовления 100 грамм
безводного раствора сульфата меди (II).
V(H2O) = m(H2O)/ 
V(H2O) = 92.1875 / 1 = 92.1875 (мл.)
Взвесили на аналитических весах 7,8125 грамм кристаллогидрата сульфата меди (II);
2) Отмерили мерным цилиндром 92,2 мл. дистиллированной воды, и перелили её в стакан;
3) Добавили в этот стакан навеску кристаллогидрата сульфата меди (II) и перемешивали полученный раствор до полного растворения соли;
4) Перелили полученный раствор в чистый мерный цилиндр, для того чтобы измерить плотность полученного раствора с помощью ареометра. Показание ареометра составило 1,051 гр./см 3 .
Полученное значение плотности раствора соответствует справочным данным о плотности 5 % раствора соли сульфата меди (II), т.е. концентрация приготовленного нами раствора действительно 5%.
б) Приготовление разбавленного раствора:
Цель работы:приготовить 100 мл. разбавленного раствора гидроксида натрия NaOH 0,1Н.
1) Определили с помощью ареометра плотность концентрированной щёлочи. Показание ареометра составило 1,057 гр./см. 3 , что по справочным данным соответствует массовой доли щёлочи в растворе 15%.
Для приготовления 100 мл. раствора гидроксида натрия 0,1 Н необходимо разбавить дистиллированной водой имеющийся 15% раствор щёлочи.
m(р-ра) = V(р-ра)∙ 
m(р-ра) = 100∙1.057 = 105.7 (грамм)
m(NaOH) = 105.7∙0.15 = 15.855 (грамм)
n(NaOH) = 15.855/40 =0.4 (моль)
0,4 моль – 100 мл.
х моль – 1000 мл.
Значит в 1000 мл. (1 литр) содержится 4 моль гидроксида натрия, поэтому Cн=4Н
4/0,1 = 40 – значит для получения 0,1Н раствора из 4Н необходимо его разбавить в 40 раз.
х = 2,5 – Значит необходимо смешать 2,5 мл. NaOH (4Н) и 97,5 мл. дистиллированной воды для получения NaOH (0,1Н)
2) С помощью ареометра определили плотность получившегося раствора – она составила 1,002 гр./см. 3 .
3) Титрованием определили концентрацию получившегося раствора. Она оказалось равна 0,1Н.
Полученное значение концентрации раствора гидроксида натрия совпадает с заданной концентрацией 0,1Н, что соответствует правильности выполнения опыта.
в) Приготовление раствора смешиванием двух растворов различной концентрации:
Цель работы: приготовить 100 гр. 8% раствора хлорида натрия NaCl, смешиванием растворов этой же соли 2 Н и 0,1Н.
1) Для приготовления 100 мл. 8% раствора хлорида натрия необходимо смешать определённые объёмы двух исходных растворов этой соли.
m(NaCl) = 0.08∙100 = 8 (грамм)
n(NaCl) = 8/58.5 = 0.137 (моль)
Пусть х – объём хлорида натрия 2 Н
x = 0.073 (л) = 73 мл.
Значит необходимо смешать 73 мл. раствора хлорида натрия 2 Н и 27 мл. . раствора хлорида натрия 0,1 Н.
2) Затем с помощью ареометра определили плотность получившегося раствора – она составила 1,055 гр./см. 3 .
Полученное значение плотности раствора соответствует справочным данным о плотности 8% раствора соли хлорида натрия, т.е. концентрация приготовленного нами раствора действительно 8%.
- Фролов В. И. Практикум по общей и неорганической химии. – М., 2002. – С. 74-79.
- Некрасов Б. В. Основы общей химии. Том 1 (3). – М. «Химия», 1969. – С. 155, 158, 160, 162, 168
Источник