Расчеты при приготовлении водных растворов
Приблизительные растворы. При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного —55,847; для серы — 32 вместо точного 32,064 и т. д.
Вещества для приготовления приблизительных растворов взвешивают на технохимических или технических весах.
Принципиально расчеты при приготовлении растворов совершенно одинаковы для всех веществ.
Количество приготовляемого раствора выражают или в единицах массы (г, кг), или в единицах объема (мл, л), причем для каждого из этих случаев вычисление количества растворяемого вещества проводят по-разному.
Пример. Пусть требуется приготовить 1,5 кг 15%-ного раствора хлористого натрия; предварительно вычисляем требуемое количе-ство соли. Расчет проводится согласно пропорции:

т. е. если в 100 г раствора содержится 15 г соли (15%), то сколько ее потребуется для приготовления 1500 г раствора?
Расчет показывает, что нужно отвесить 225 г соли, тогда воды иужио взять 1500 — 225 = 1275 г. ¦
Если же задано получить 1,5 л того же раствора, то в этом случае по справочнику узнают его плотность, умножают последнюю на заданный объем и таким образом находят массу требуемого количества раствора. Так, плотность 15%-нoro раствора хлористого натрия при 15 0C равна 1,184 г/см3. Следовательно, 1500 мл составляет

Следовательно, количество вещества для приготовления 1,5 кг и 1,5 л раствора различно.
Расчет, приведенный выше, применим только для приготовления растворов безводных веществ. Если взята водная соль, например Na2SO4-IOH2O1 то расчет несколько видоизменяется, так как нужно принимать во внимание и кристаллизационную воду.
Пример. Пусть нужно приготовить 2 кг 10%-ного раствора Na2SO4, исходя из Na2SO4 *10H2O.
Молекулярный вес Na2SO4 равен 142,041, a Na2SO4*10H2O 322,195, или округленно 322,20.
Расчет ведут вначале па безводную соль:

Следовательно, нужно взять 200 г безводной соли. Количество десятиводной соли находят из расчета:

Воды в этом, случае нужно взять: 2000 — 453,7 =1546,3 г.
Так как раствор не всегда готовят с пересчетом на безводную соль, то на этикетке, которую обязательно следует наклеивать на сосуд с раствором, нужно указать, из какой соли приготовлен раствор, например 10%-ный раствор Na2SO4 или 25%-ный Na2SO4*10H2O.
Часто случается, что приготовленный ранее раствор нужно разбавить, т. е. уменьшить его концентрацию; растворы разбавляют или по объему, или по массе.
Пример. Нужно разбавить 20%-ный раствор сернокислого аммония так, чтобы получить 2 л 5%-иого раствора. Расчет ведем следующим путем. По справочнику узнаем, что плотность 5%-ного раствора (NH4)2SO4 равна 1,0287 г/см3. Следовательно, 2 л его должны весить 1,0287*2000 = 2057,4 г. В этом количестве должно находиться сернокислого аммония:

Теперь можно подсчитать, сколько нужно взять 20%-ного рас* твора, чтобы получить 2 л 5%-ного раствора.

Полученную массу раствора можно пересчитать на объем его. Для этого массу раствора делят на его плотность (плотность 20%-ного раствора равна 1.1149 г/см3), т. е.

Учитывая, что при отмеривании могут произойти потери, нужно взять 462 мл и довести их до 2 л, т. е. добавить к ним 2000—462 = = 1538 мл воды.
Если же разбавление проводить по массе, расчет упрощается. Но вообще разбавление проводят из расчета на объем, так как жидкости, особенно в больших количествах, легче отмерить по объему, чем взвесить.
Нужно помнить, что при всякой работе как с растворением, так и с разбавлением никогда не следует выливать сразу всю воду в сосуд. Водой ополаскивают несколько раз ту посуду, в которой проводилось взвешивание или отмеривание нужного вещества, и каждый раз добавляют эту воду в сосуд для раствора.
Когда не требуется особенной точности, при разбавлении растворов или смешивании их для получения растворов другой концентрации можно пользоваться следующим простым и быстрым способом.
Возьмем разобранный уже случай разбавления 20%-ного раствора сернокислого аммония до 5%-ного. Пишем вначале так:

где 20 — концентрация взятого раствора, 0 — вода и 5’—-требуемая концентрация. Теперь из 20 вычитаем 5 и полученное значение пишем в правом нижнем углу, вычитая же нуль из 5, пишем цифру в правом верхнем углу. Тогда схема примет такой вид:

Это значит, что нужно взять 5 объемов 20%-ного раствора и 15 объемов воды. Конечно, такой расчет не отличается точностью.
Если смешивать два раствора одного и того же вещества, то схема сохраняется та же, изменяются только числовые значения. Пусть смешением 35%-ного раствора и 15%-ного нужно приготовить 25%-ный раствор. Тогда схема примет такой вид:

т. е. нужно взять по 10 объемов обоих растворов. Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Разберем несколько важнейших случаев.
Приготовление разбавленного раствора. Пусть с — количество раствора, m%—концентрация раствора, который нужно разбавить до концентрации п%. Получающееся при этом количество разбавленного раствора х вычисляют по формуле:
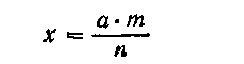
а объем воды v для разбавления раствора вычисляют по формуле:
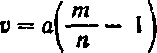
Смешивание двух растворов одного и того же вещества различной концентрации для получения раствора заданной концентрации. Пусть смешиванием а частей m%-ного раствора с х частями п%-ного раствора нужно получить /%-ный раствор, тогда:

Точные растворы. При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
Взвешивание проводят или на часовом стекле, или в бюксе. Отвешенное вещество высыпают в чисто вымытую мерную колбу через чистую сухую воронку небольшими порциями. Затем из промывалки несколько раз небольшими порциями воды обмывают над воронкой бнже или часовое стекло, в котором проводилось взвешивание. Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Для пересыпания твердых кристаллов или порошков в мерную колбу очень удобно пользоваться воронкой, изображенной на рис. 349. Такие воронки изготовляют емкостью 3, 6, и 10 см3. Взвешивать навеску можно непосредственно в этих воронках (негигроскопические материалы), предварительно определив их массу. Навеска из воронки очень легко переводится в мерную колбу. Когда навеска пересыпается, воронку, не вынимая из горла колбы, хорошо обмывают дистиллированной водой из промывалки.
Как правило, при приготовлении точных растворов и переведении растворяемого вещества в мерную колбу растворитель (например, вода) должен занимать не более половины емкости колбы. Закрыв пробкой мерную колбу, встряхивают ее до полного растворения твердого вещества. После этого полученный раствор дополняют водой до метки и тщательно перемешивают.
Молярные растворы. Для приготовления 1 л 1 M раствора какого-либо вещества отвешивают на аналитических весах 1 моль его и растворяют, как указано выше.
Пример. Для приготовления 1 л 1 M раствора азотнокислого серебра находят в таблице или подсчитывают молекулярную массу AgNO3, она равна 169,875. Соль отвешивают и растворяют в воде.
Если нужно приготовить более разбавленный раствор (0,1 или 0,01 M), отвешивают соответственно 0,1 или 0,01 моль соли.
Если же нужно приготовить меньше 1 л раствора, то растворяют соответственно меньшее количество соли в соответствущем объеме воды.
Нормальные растворы готовят аналогично, только отвешивая не 1 моль, а 1 грамм-эквивалент твердого вещества.
Если нужно приготовить полунормальный или децинормальный раствор, берут соответственно 0,5 или 0,1 грамм-эквивалента. Когда готовят не 1 л раствора, а меньше, например 100 или 250 мл, то берут1/10 или 1/4 того количества вещества, которое требуется для приготовления I л, и растворяют в соответствующем объеме воды.

Рис 349. Воронки для пересыпания навески а колбу.
После приготовления раствора его нужно обязательно проверить титрованием соответствующим раствором другого вещества с известной нормальностью. Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
В производственных лабораториях иногда готовят точные растворы «по определяемому веществу». Применение таких растворов облегчает расчеты при анализах, так как достаточно умножить объем раствора, пошедший на титрование, на титр раствора, чтобы получить содержание искомого вещества (в г) во взятом для анализа количестве какого-либо раствора.
Расчет при приготовлении титрованного раствора по определяемому веществу ведут также по грамм-эквиваленту растворяемого вещества, пользуясь формулой:

Пример. Пусть нужно приготовить 3 л раствора марганцовокислого калия с титром по железу 0,0050 г/мл. Грамм-эквивалент KMnO4 равен 31,61., а грамм-эквивалент Fe 55,847.
Вычисляем по приведенной выше формуле:

Стандартные растворы. Стандартными называют растворы с разными, точно определенными концентрациями, применяемые в колориметрии, например растворы, содержащие в 1 мл 0,1, 0,01, 0,001 мг и т. д. растворенного вещества.
Кроме колориметрического анализа, такие растворы бывают нужны при определении рН, при нефелометрических определениях и пр. Иногда стандартные растворы» хранят в запаянных ампулах, однако чаще приходится готовить их непосредственно перед применением. Стандартные растворы готовят в объеме не больше 1 л, а ча ще — меньше. Только при большом расходе стандартного раствори можно готовить несколько литров его и то при условии, что стандартный раствор не будет храниться длительный срок.
Количество вещества (в г), необходимое для получения таких растворов, вычисляют по формуле:

Пример. Нужно приготовить стандартные растворы CuSO4 • 5H2O для колориметрического определения меди, причем в 1 мл первого раствора должно содержаться 1 мг меди, второго — 0,1 мг, третьего —0,01 мг, четвертого — 0,001 мг. Вначале готовят достаточное количество первого раствора, например 100 мл.
В данном случае Mi = 249,68; АСu = 63,54; следовательно, для приготовления 100 мл раствора, 1 мл которого содержал бы 1 мг меди (Т = 0,001 г/мл), нужно взять

Навеску соли переносят в мерную колбу емкостью 100 мл и добавляют воду до метки. Другие растворы готовят соответствующим разбавлением приготовленного.
Эмпирические растворы. Концентрацию этих растворов чаще всего выражают в г/л или г/мл. Для приготовления эмпирических растворов применяют очищенные перекристаллизацией вещества или реактивы квалификации ч. д. а. или х. ч.
Пример. Нужно приготовить 0,5 л раствора CuSO4, содержашего Cu 10 мг/мл. Для приготовления раствора применяют CuSO4 • 5H2O.
Чтобы подсчитать, сколько следует взять этой солн для приготовления раствора заданного объема, подсчитывают, сколько Cu должно содержаться в нем. Для этого объем умножают на заданную концентрацию, т. е.
500*10 = 5000 мг, или 5,0000 г
После этого, зная молекулярный вес соли, подсчитывают нужное количество ее:

На аналитических весах отвешивают в бюксе точно 19,648 г чистой соли, переводят ее в мерную колбу емкостью 0,5 л. Растворение проводят, как указано выше.
Источник
Практическая работа по неорганической химии «Приготовление растворов заданной концентрации» 11 класс
Раздел 1 ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
Тема 1.4 Вода. Растворы. Электролитическая диссоциация
Цель работы: освоить расчеты и методику приготовления растворов определенной концентрации; отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
1. Ознакомиться с техникой приготовления растворов;
2. Сформировать умение выполнять расчеты по вычислению концентрации растворов.
Растворы играют важную роль в живой и неживой природе, а также в науке и технике. Большинство физиологических процессов в организмах человека, животных и растений, различных промышленных процессов, биохимических процессов в почвах и т.п. протекают в растворах.
Раствор – это гомогенная многокомпонентная система, в которой одно вещество распределено в среде другого или других веществ. Растворы могут быть в газообразном, жидком и твердом агрегатных состояниях. Масса раствора может быть вычислена по формуле:
Для выражения состава раствора используют количественные характеристики растворов или концентрации. Существуют разные способы выражения концентрации растворов:
1. Массовая доля растворенного вещества ( w )
где m р.в — масса растворенного вещества,
m р-ра – масса раствора, г.
Массовая доля растворенного вещества, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора, (измеряется в %, поэтому ее называют процентная концентрация).
Массовая доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %).
2. Молярная концентрация (См)
где m – масса растворенного вещества, г;
М – молярная масса, г/моль;
V — объем раствора, мл.
Задание: приготовить 70 г раствора соли (из воды и NaCl ), массовая доля которого 20% или 0,2.
Сделать расчет и запомнить навыки приготовления растворов из демонстрации.
При решении задач с изменением концентрации растворов необходимо помнить, что характеристики (m, V, w и пр.) даны для разных растворов: исходного и полученного. Важно не перепутать эти характеристики между собой. Поэтому рекомендуется обозначать растворы цифрами 1,2,3 и ставить соответствующие индексы у величин. Например, масса первого раствора будет записана так: m 1р-ра , а массовая доля вещества во втором растворе: w 2 .
Если решение таких задач вызывает у вас трудности, то попытайтесь себе представить этот процесс (упаривание, разбавление, и пр.) с помощью схематичного рисунка.
Решение задач на упаривание растворов
При решении данного типа задач, следует помнить, что в большинстве случаев испаряется вода, и, следовательно, уменьшается масса полученного раствора. Масса вещества, как правило, остается неизменной.
Решение задач на концентрирование растворов (добавление вещества)
При решении таких задач важно понимать, что при добавлении вещества концентрация раствора увеличивается, то есть масса вещества в полученном растворе = масса вещества в исходном растворе + масса добавленного вещества.
Решение задач на разбавление растворов
При решении задач данного типа следует помнить, что масса растворенного вещества остается неизменной, изменяется лишь масса растворителя и, соответственно, масса всего раствора.
Вопросы для самоконтроля
1.Что такое раствор и из каких компонентов он состоит?
2.Как определить массу раствора, зная его плотность и объем?
3.Какие существуют способы выражения концентрации раствора?
4.Как определить массовую долю растворенного вещества и в каких единицах она выражается?
5.Какой раствор называется молярным?
1.Сколько граммов хлорида натрия требуется для приготовления раствора массой 300г с массовой долей NaCl 10%?
2.Сколько граммов карбоната калия содержится в 0,2М растворе объемом 250мл?
3. Какой объем газа образуется при взаимодействии 250г 30% раствора серной кислоты с цинком?
4. Определите молярную концентрацию раствора, в 3-х литрах которого содержится 27г Na2CO3.
5. Сколько граммов воды надо испарить из 800 г 15%-го раствора вещества, чтобы увеличить его массовую долю на 5%?
1.Сколько граммов хлорида бария требуется для приготовления раствора массой 500г с массовой долей ВаCl2 10%?
2. Сколько граммов карбоната натрия содержится в 0,5М растворе объемом 250мл?
3. Какой объем газа образуется при взаимодействии 500г 70% раствора серной кислоты с магнием?
4. Сколько граммов NaCl и воды нужно взять, чтобы приготовить 300г физиологического раствора, массовая доля соли в котором составляет 0,9%
5. К 200г 15-%-ного раствора хлорида натрия добавили 40 г воды. Определите массовую долю соли в полученном растворе.
1.Определите молярную концентрацию раствора, в 3-х литрах которого содержится 40г КNO3.
2. В 160г воды растворили 40г соли. Какова массовая доля соли в данном растворе?
3. Какой объем газа образуется при взаимодействии 40мл 2М раствора НСl с железом?
4. Определите молярную концентрацию раствора, полученного при растворении нитрата калия массой 21г в воде массой 200г, если плотность полученного раствора равна 1,10 г/мл.
5. Сколько граммов воды надо испарить из 250 г 7%-го раствора вещества, чтобы увеличить его массовую долю на 10%?
1. В 100г воды растворили 150г сахара. Вычислите массовую долю (в %) сахара в растворе.
2.Необходимо приготовить 2 л 0,1М водного раствора СuSO4.Какая масса медного купороса для этого потребуется.
3. Определите молярную концентрацию раствора, в 4-х литрах которого содержится 54г Na2CO3.
4. Вычислите какой объем водорода (н.у.) выделяется при взаимодействии 300 мл 10% соляной кислоты (пл. 1,04 г/мл) с магнием.
5. Сколько граммов воды надо испарить из 750 г 12%-го раствора вещества, чтобы увеличить его массовую долю на 2%?
1. Требуется приготовить раствор массой 320г с массовой долей хлорида калия 3%. Рассчитайте массу КСl и массу воды, которые необходимы для приготовления раствора.
2. Определите молярную концентрацию раствора, полученного при растворении нитрата натрия массой 12г в воде массой 400г, если плотность полученного раствора равна 1,12 г/мл.
3. Вычислите какой объем воды потребуется для разбавления 200мл 96% этилового спирта (пл.0,8г/мл), чтобы получить10% раствор.
4. Определите молярную концентрацию раствора, в 3-х литрах которого содержится 80г Al Cl3
5. К 250г 10-%-ного раствора хлорида натрия добавили 25 г воды. Определите массовую долю соли в полученном растворе.
1.Нитрат калия массой 30 г растворили в воде объемом 200 мл, плотность воды 1г/мл . Рассчитайте массовую долю соли в растворе.
2. Необходимо приготовить 2 л 0,1М водного раствора СuSO4.Какая масса сульфата меди для этого потребуется.
3. Определите молярную концентрацию раствора, в 2-х литрах которого содержится 60г FeCl3
4. Вычислите какой объем водорода (н.у.) выделяется при взаимодействии 100 мл 40% соляной кислоты (пл. 1,04 г/мл) с магнием.
5. К 100г 25-%-ного раствора хлорида натрия добавили 50 г воды. Определите массовую долю соли в полученном растворе.
1. В 150г воды растворили 15г сахара. Вычислите массовую долю (в %) сахара в растворе.
2.Необходимо приготовить 0,2л 0,5М водного раствора СuSO4. Какая масса сульфата меди для этого потребуется.
3 . Определите молярную концентрацию раствора, в 4-х литрах которого содержится 54г Na2CO3.
4. Вычислите какой объем водорода (н.у.) выделяется при взаимодействии 300 мл 10% соляной кислоты (пл. 1,04 г/мл) с магнием.
5. Сколько граммов воды надо испарить из 750 г 12%-го раствора вещества, чтобы увеличить его массовую долю на 2%?
1. Внимательно прочитайте раздел Краткие теоретические сведения.
2. Решите задачи предложенного варианта.
3. Оформите отчет.
Содержание отчета: укажите номер практической работы, тему, цель, решите задачи полученного варианта, используя теоретический материал. Сформулируйте и запишите вывод.
Критерии оценки практической работы
Оценка «5»: 5 задач решены верно или в логическом рассуждении и решении нет ошибок, все задачи решены рациональным способом.
Оценка «4»: 4 задачи решены верно или в логическом рассуждении и решении нет существенных ошибок, но задачи решены нерациональным способом или допущено не более двух несущественных ошибок.
Оценка «3»: 3 задачи решены верно или в логическом рассуждении нет существенных ошибок, но допущены существенная ошибка в математических расчетах.
Оценка «2»: решены только 2 задачи или имеются существенные ошибки в логическом рассуждении и в решении.
Оценка «1»: не приступил к практической части занятия
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Источник