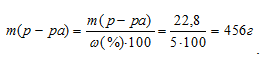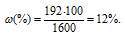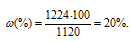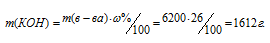h2so4 как приготовить 1 н раствор?? спасибо
Надо принять дополнительные данные: какой объем 1 н раствора вам нужен и какую концентрацию имеет серная кислота, которую вы будете разбавлять.
Пусть вам требуется 1 литр 1 н раствора, а в лаборатории имеется обычная реактивная серная кислота с концентрацией 95 % (плотность 1,84 г/мл).
Эквивалентная масса (масса моля эквивалентов) для серной кислоты составляет 49 г/моль-экв, т. е. 1 литр 1 н раствора должен содержать 49 г чистой кислоты.
Разбавляемая реактивная кислота содержит 95 г чистой кислоты на 100 г или на 100/1,84 = 54,3 мл. В литре реактивной кислоты содержится 95*1000/54,3 = 1750 г чистой H2SO4.
1750 г H2SO4 содержится в 1000 мл разбавляемого раствора
—49 г —————————-в Х мл——————————————
Х = 28 мл
Таким образом, для приготовления 1 литра 1 н раствора надо взять 28 мл раствора реактивной кислоты и разбавить до 1 л.
Технически это удобно сделать так: взвесить 28*1,84 = 51,52 г исходного раствора и отдельно воды несколько меньше литра в литровом стакане. Кислоту надо медленно вливать в воду и размешивать стеклянной палочкой. Полученный раствор охладить до температуры помещения (разогрев будет при разбавлении концентрированного раствора). Охлажденный раствор влить в литровую мерную колбу и довести водой до метки.
1 н раствор используется обычно в аналитических целях. Поэтому надо точно знать концентрацию разбавляемого раствора (измерить его плотность и посмотреть в таблице точную концентрацию).
А вообще-то в аналитической лаборатории надо использовать фиксаналы (стандарт-титры) растворов для анализа, в том числе и для серной кислоты.
Источник
Растворы кислот
Приблизительные растворы. В большинстве случаев в лаборатории приходится пользоваться соляной, серной и азотной кислотами. Кислоты имеются в продаже в виде концентрированных растворов, процентное содержание которых определяют по их плотности.
Кислоты, применяемые в лаборатории, бывают технические и чистые. Технические кислоты содержат примеси, а потому при аналитических работах не употребляются.
Концентрированная соляная кислота на воздухе дымит, поэтому работать с ней нужно в вытяжном шкафу. Наиболее концентрированная соляная кислота имеет плотность 1,2 г/см3 и содержит 39,11%’ хлористого водорода.
Разбавление кислоты проводят по расчету, описайному выше.
Пример. Нужно приготовить 1 л 5%-ного раствора соляной кислоты, пользуясь раствором ее с плотностью 1,19 г/см3. По справочнику узнаем, что 5%,-ный раствор нмеет плотность 1,024 г/см3; следовательно, 1 л ее будет весить 1,024*1000 = 1024 г. В этом количестве должно содержаться чистого хлористого водорода:

Кислота с плотностью 1,19 г/см3 содержит 37,23% HCl (находим также по справочнику). Чтобы узнать, сколько следует взять этой кислоты, составляют пропорцию:

или 137,5/1,19 = 115,5 кислоты с плотностью 1,19 г/см3, Отмерив 116 мл раствора кислоты, доводят объем его до 1 л.
Так же разбавляют серную кислоту. При разбавлении ее следует помнить, что нужно приливать кислотук воде
, а не наоборот. При разбавлении происходит сильное разогревание, и если приливать воду к кислоте, то возможно разбрызгивание ее, что опасно, так как серная кислота вызывает тяжелые ожоги. Если кислота попала на одежду или обувь, следует быстро обмыть облитое место большим количеством воды, а затем нейтрализовать кислоту углекислым натрием или раствором аммиака. При попадании на кожу рук или лица нужно сразу же обмыть это место большим количеством воды.
Особой осторожности требует обращение с олеумом, представляющим моногидрат серной кислоты, насыщенный серным ангидридом SO3. По содержанию последнего олеум бывает нескольких концентраций.
Следует помнить, что при небольшом охлаждении олеум закристаллизовывается и в жидком состоянии находится только при комнатной температуре. На воздухе он дымит с выделением SO3, который образует пары серной кислоты при взаимодействии с влагой воздуха.
Большие трудности вызывает переливание олеума из крупной тары в мелкую. Эту операцию следует проводить или под тягой, или на воздухе, но там, где образующаяся серная кислота и SO3 не могут оказать какого-либо вредного действия на людей и окружающие предметы.
Если олеум затвердел, его следует вначале нагреть, поместив тару с ним в теплое помещение. Когда олеум расплавится и превратится в маслянистую жидкость, его нужно вынести на воздух и там переливать в более мелкую посуду, пользуясь для этого способом передавлива-ния при помощи воздуха (сухого) или инертного газа (азота).
При смешивании с водой азотной кислоты также происходит разогревание (не такое, правда, сильное, как в случае серной кислоты), и поэтому меры предосторожности должны применяться и при работе с ней.
В лабораторной практике находят применение твердые органические кислоты. Обращение с ними много проще и удобнее, чем с жидкими. В этом случае следует заботиться лишь о том, чтобы кислоты не загрязнялись чем-либо посторонним. При необходимости твердые органические кислоты очищают перекристаллизацией (см, гл. 15 «Кристаллизация»),
Точные растворы. Точные растворы кислот готовят так же, как и приблизительные, с той только разницей, что вначале стремятся получить раствор несколько большей концентрации, чтобы после можно было его точно, по расчету, разбавить. Для точных растворов берут только химически чистые препараты.
Нужное количество концентрированных кислот обычно берут по объему, вычисленному на основании плотности.
Пример. Нужно приготовить 0,1 и. раствор H2SO4. Это значит, что в I л раствора должно содержаться:

Кислота с плотностью 1,84 г\смг содержит 95,6% H2SO4 н для приготовления 1 л 0,1 н. раствора нужно взять следующее количество (х) ее (в г):

Соответствующий объем кислоты составит:

Отмерив из бюретки точно 2,8 мл кислоты, разбавляют ее до 1 л в мерной колбе и затем титруют раствором щелочи п устанавливают нормальность полученного раствора. Если раствор получится более концентрированный), к нему добавляют из бюретки рассчитанное количество воды. Например, при титровании установлено, что 1 мл 6,1 н. раствора H2SO4 содержит не 0,0049 г H2SO4, а 0,0051 г. Для вычисления количества воды, которое необходимо для приготовления точно 0,1 н. раствора, составляем пропорцию:

Расчет показывает, что этот объем равен 1041 мл раствор нужно добавить 1041 — 1000 = 41 мл воды. Следует еще учесть то количество раствора, которое взято для титрования. Пусть взято 20 мл, что составляет 20/1000 = 0,02 от имеющегося объема. Следовательно, воды нужно добавить не 41 мл, а меньше: 41 — (41*0,02) = = 41 —0,8 = 40,2 мл.
* Для отмеривания кислоты пользуются тщательно высушенной бюреткой с притертым краном. .
Исправленный раствор следует снова проверить на содержание вещества, взятого для растворения. Точные растворы соляной кислоты готовят также ионообменным способом, исходя из точной рассчитанной навески хлористого натрия. Рассчитанную и отвешенную на аналитических весах навеску растворяют в дистиллированной или деминерализованной воде, полученный раствор пропускают через хроматографическую колонку, наполненную катионитом в Н-форме. Раствор, вытекающий из колонки, будет содержать эквивалентное количество HCl.
Как правило, точные (или титрованные) растворы следует сохранять в плотно закрытых колбах, В пробку сосуда обязательно нужно вставлять хлоркальциевую трубку, заполненную в случае раствора щелочи натронной известью или аскаритом, а в случае кислоты — хлористым кальцием или просто ватой.
Для проверки нормальности кислот часто применяют прокаленный углекислый натрий Na2COs. Однако он обладает гигроскопичностью и поэтому не полностью удовлетворяет требованиям аналитиков. Значительно удобнее пользоваться для этих целей кислым углекислым калием KHCO3, высушенным в эксикаторе над CaCl2.
При титровании полезно пользоваться «свидетелем», для приготовления которого в дистиллированную или деминерализованную воду добавляют одну каплю кислоты (если титруют щелочь) или щелочи (если титруют кислоту) и столько капель индикаторного раствора, сколько добавлено в титруемый раствор.
Приготовление эмпирических, по определяемому веществу, и стандартных растворов, кислот проводят по расчету с применением формул, приведенных для этих и описанных выше случаев.
Источник
Получение 5%-ного раствора серной кислоты
Задача 401.
Какой объем воды надо прибавить к 100 мл 20%-ного (по массе) раствора H2SO4 ( p = 1,14 г/мл), чтобы получить 5%-ный раствор?
Решение:
Масса 100 мл 20%-ного раствора H2SO4 равна 100 . 1,14 = 114 г. В этом растворе содержится 20% H2SO4, т.е. 22,8г (114 . 0,2 = 22,8). По условию задачи эта масса составляет 5% от общей массы разбавленного раствора. Тогда масса полученного раствора может быть рассчитана по уравнению:
где

Следовательно, к исходному раствору необходимо прилить 342г воды (456 – 114 = 342).
Ответ: 342г.
Задача 402.
К 500 мл 32%-ной (по массе) HNO3 (р = 1,20 г/мл) прибавили 1л воды. Чему равна массовая доля HNO3 в полученном растворе?
Решение:
Массу раствора рассчитаем по формуле: m(р-ра) = pV, где m(р-ра) — масса раствора, p — плотность раствора,
V- объём раствора.
Находим массу раствора HNO3: m(р-ра) — 1,2 . 500 = 600. Находим массу растворённого HNO3:
m(HNO3) = 600 . 0,32 = 192 г. Масса раствора после смешения составляет 1600 г (600 + 1000 = 1600).
Массовую долю в полученном раствора находим из формулы:
где

Ответ: 12%.
Задача 403.
До какого объема надо разбавить 500 мл 20%-ного (по массе) раствора NaCl (p = 1,152 г/мл), чтобы получить 4,5%-ный раствор (p = 1,029 г/мл)?
Решение:
Находим массу 500 мл 20%-ного раствора NaCl: m(р-ра) = 115,2 . 500 = 576 г. Масса NaCl, содержащаяся в 576 г этого раствора, составляет 115,2г (576 . 0,20 = 115,2). Массу раствора NaCl, содержащуюся в растворе с массовой долей 4,5% рассчитаем, используя формулу:содержащуюся в растворе с массовой долей 4,5% рассчитаем, используя формулу:
где

Объём раствора находим по формуле: m(р-ра) = pV, где m(р-ра) — масса раствора, p — плотность раствора,
V — объём раствора.
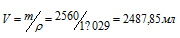
Ответ: 2,49 л.
Задача 404.
Найти массовую долю азотной кислоты в растворе, в 1л которого содержится 224г HNO3 (p = 1,12 г/мл).
Решение:
Находим массу 1л азотной кислоты по формуле: m(р-ра) = p . V, где m(р-ра) — масса раствора, p — плотность раствора, V — объём раствора.
m(HNO3) = 1,12 . 1000 = 1120 г.
Для расчета массовой доли используем формулу:
где

Ответ: 20%.
Задача 405.
Плотность 26%-ного (по массе) раствора КОН равна 1,24 г/мл. Сколько молей КОН находится в 5л раствора?Решение:
Находим массу 5л раствора КОН по формуле: m(р-ра) = pV, где m(р-ра) — масса раствора, p — плотность раствора, V — объём раствора.
m(КОН) = 1,24 . 5000 = 6200 г.
Для расчета массы КОН используем формулу:
где

М(КОН)=56 г/моль. Следовательно, количество КОН можно рассчитать:
Источник
Как приготовить раствор кислоты из порошка
Здравствуйте!
мне нужно приготовить 5% раствор щавелевой кислоты, сейчас она у меня в виде порошка.
правильно ли я понял, что для приготовления 1 литра надо тупо взять 0.95 л. дистилированной воды и 50 грамм порошка?
п. с. на мешке написано «Щавелевая кислота, 2-водная».
Чтобы правильно приготовить 5%-ный раствор, нужно сделать поправку на кристаллизационную воду в препарате. Составляется такая пропорция:
5 г Н2С2О4 —————90 г/моль
Х г Н2С2О4*2Н2О——126 г/моль
Отсюда Х = 5*126/90 = 7 г.
Нужно взвесить 7 г кристаллогидрата и добавить 93 г воды, или 70 г + 930 г воды. Естественно, объём будет меньше 1 л, т. к. плотность такого раствора — больше 1
Неправильно. Молекулы кислоты связываются с молекулами воды и объем раствора почти не увеличивается. Поэтому литр там не получится, я гарантирую это.
В общем правильно. Но если быть точнее, надо учитывать и химически связанную воду.
ну примерно так правильно поняли
5% раствор — это на литр 50 грамм порошка.
5% — это 950 грамм воды и 50 грамм кислоты.
Почему не 50 грамм на литр? И не 50 грамм, доведенные водой до литра? Да потому, что это МАССОВАЯ ДОЛЯ! ! А не объемная концентрация.
Кстати, щавелевая кислота обладает какой-никакой гигроскопичностью, так что если нужна точная концентрация, лучше титрануть потом.. .
А если это дигидрат, как совершенно верно указал Вячеслав, то это будет не 50 грамм, а аж 70! На 930 г воды.
Источник