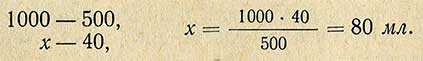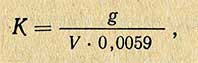Реактивы и техника приготовления растворов
Растворы щелочей. Едкие щелочи и их растворы активно поглощают влагу и углекислоту из воздуха, поэтому приготовление из них растворов точного титра затруднено. Лучше всего такие растворы изготовлять из фиксаналов. Для этого берут пробирку с фиксаналом требуемой нормальности и мерную колбу на 1 л. В колбу вставляют стеклянную воронку с вложенным в нее стеклянным бойком, острый конец которого обращен вверх.
Когда боек будет правильно уложен в воронке, ампуле с фиксаналом дают свободно падать, чтобы тонкое дно ампулы разбилось при ударе об острый конец бойка. После этого пробивают боковое углубление ампулы и дают содержимому вытечь. Затем, не меняя положения ампулы, ее тщательно промывают хорошо прокипяченной дистиллированной водой, остуженной до температуры 35- 40°С и взятой в таком количестве, чтобы по охлаждении раствора до 20°С надо было бы добавить до метки лишь несколько капель. Титрованный раствор щелочи следует хранить в таких условиях, которые исключают возможность его соприкосновения с воздухом.
Если же фиксанала нет, титрованные растворы приготовляют из препаратов едкого натра (или едкого кали). Молекулярная масса NaOH равна 40,01. Это число одновременно является и его грамм-эквивалентом.
Чтобы приготовить 1 л 1 и. раствора NaOH, нужно взять 40 г химически чистого едкого натра, а для приготовления 1 л0,1н. раствора — в десять раз меньше, т. е. 4 г.
Для удобства расчета требуемого количества исходных веществ на приготовление 1 л титрованных растворов щелочей разной нормальности рекомендуем пользоваться данными, приведенными в таблице 31.
Таблица 31
Исходные химические вещества, г
Молекулярная масса
Грамм-эквивалент
Нормальность раствора
Вещества для
установки
титров
1
0,5
0,2
0,1
0,05
0,02
0,01
NaOH
40,01
40,01
40,01
20,0
8,0
4,0
2,0
0,8
0,4
Янтарная плп щавелевая кислота
КОН
56,10
56,10
56,10
28,05
11,20
5,60
2,80
1,12
0,56
То же
Чтобы приготовить 1 л 0,1 н. раствора едкого натра, отвешивают немного больше 4 г (4,3-4,5 г) препарата и растворяют в небольшом объеме дистиллированной воды (около 7 мл).
После отстаивания раствор осторожно сливают (без осадка) в литровую мерную колбу и доводят дистиллированной свежепрокипяченной водой до метки.
Приготовленный раствор хорошо перемешивают и помещают в бутыль, защищенную от попадания углекислоты. После этого устанавливают титр, т. е. точную концентрацию раствора.
Титр можно устанавливать по щавелевой или янтарной кислоте. Щавелевая кислота (СгН204-2Н20) двухосновная, и, следовательно, ее грамм эквивалент будет равен половине молекулярной. Если молекулярная масса щавелевой кислоты равна 126,05 г, то ее грамм-эквивалент будет 126,05 : 2=63,025 г.
Имеющуюся щавелевую кислоту следует один-два раза перекристаллизовать и только после этого применять для установки титра.
Перекристаллизацию проводят следующим образом: берут произвольное количество вещества, предназначенное для перекристаллизации, растворяют нагреванием, стараясь получить возможно большую концентрацию раствора или насыщенный раствор. При необходимости этот раствор фильтруют через воронку для горячего фильтрования. Фильтрат собирают в колбу Эрленмейера, фарфоровую чашку или стакан.
В зависимости от характера кристаллизации вещества насыщенный в горячем состоянии раствор охлаждают. Для быстрого охлаждения раствора при перекристаллизации кристаллизатор помещают в холодную воду, снег или лед. При медленном охлаждении раствор оставляют стоять при температуре окружающего воздуха.
Если выпали очень мелкие кристаллы, их снова растворяют, нагревая; сосуд, в котором осуществлялось растворение, сразу же обертывают в несколько слоев полотенцем, накрывают часовым стеклом и оставляют стоять в полном покое в течение 12-15 ч.
Затем кристаллы отделяют от маточного раствора, фильтруя под вакуумом (воронка Бюхнера), тщательно отжимают, промывают и подсушивают.
Приготавливая 0,1 н. раствор NaOH, необходимо иметь раствор щавелевой кислоты такой же нормальности, для этого на 1 л раствора ее нужно взять 63,025 : 10=6,3025 г. Но для установки титра такого количества раствора щавелевой кислоты много; достаточно приготовить 100 мл. Для этого на аналитических весах отвешивают около 0,63 г перекристаллизованной щавелевой кислоты с точностью до четвертого десятичного знака, например 0,6223 г. Взятую навеску щавелевой кислоты растворяют в мерной колбе (на 100 мл). Зная массу взятого вещества и объем раствора, легко вычислить его точную концентрацию, которая в данном случае равна не 0,1 н., а несколько меньше.
Из приготовленного раствора берут пипеткой 20 мл, добавляют несколько капель фенолфталеина и титруют приготовленным раствором щелочи до появления слабого розового окрашивания.
Пусть на титрование пошло 22,05 мл щелочи. Как же определить ее титр и нормальность?
Щавелевой кислоты было взято 0,6223 г вместо теоретически рассчитанного количества 0,6303 г. Следовательно, нормальность ее будет равна не точно 0,1
Чтобы вычислить нормальность щелочи, воспользуемся соотношением VN=ViNt, т. е. произведение объема на нормальность известного раствора равно произведению объема на нормальность для неизвестного раствора. Получаем: 20-0,09873 =22,05-а:, откуда
Чтобы вычислить титр или содержание NaOH в 1 мл раствора, следует нормальность умножить на грамм-эквивалент щелочи и полученное произведение разделить на 1000. Тогда титр щелочи будет
Но этот титр не соответствует 0,1 н. раствору NaOH. Для этого прибегают к коэффициенту к, т. е. отношению практического титра к теоретическому. В данном случае он будет равен
При использовании для установки титра янтарной кислоты раствор ее приготовляют в том же порядке, что и щавелевой, исходя из следующего расчета: молекулярная масса янтарной кислоты (С4Н604) равна 118,05 г, но так как она двухосновная, то ее грамм-эквивалент 59,02 г.
Чтобы приготовить 1 л децинормального раствора янтарной кислоты, ее нужно взять в количестве 59,02 : 10 = =5,902, а для 100 мл раствора -0,59 г.
Установка титра 0,1 н. раствора NaOH весовым методом. Для установки титра 0,1 н. раствора NaOH берем навеску янтарной кислоты с точностью до 0,0001 г (например, 0,1827 г). Навеску растворяем в дистиллированной воде (около 100 мл), затем добавляем 3-5 капель фенолфталеина и титруем щелочью (NaOH). Предположим, что на титрование пошло 28 мл NaOH. Вычисление титра NaOH и поправку к нему проводим следующим образом: так как грамм-эквивалент NaOH, равный 40,01 г, соответствует грамм-эквиваленту янтарной кислоты, равному 59,02 г, то, составляя пропорцию, узнаем, какому количеству NaOH соответствует содержащееся в навеске количество янтарной кислоты: 40,01-59,02
Вычисляем титр NaOH, т. е. содержание NaOH в 1 мл раствора. Оно равно: 0,1238 : 28=0,00442. Поправка к титру NaOH равна отношению титра практического к теоретическому
Проверка нормальности раствора щелочи по титрованному раствору кислоты. В три конические колбочки отмеряют бюреткой по 20-25 мл титрованного раствора кислоты (НС1 или H2S04) и титруют раствором NaOH до изменения окраски метилоранжа.
Допустим, что на титрование трех проб по 20 мл 0,1015 н. раствора НС1 затрачено в среднем 19,50 мл раствора NaOH. Нормальность щелочи будет
Растворы кислот. В большинстве случаев в лаборатории приходится иметь дело с серной, соляной и азотной кислотами. Они находятся в виде концентрированных растворов, процентное содержание которых узнаем по плотности.
При аналитических работах используем химически чистые кислоты. Чтобы приготовить раствор той или иной кислоты, количество концентрированных кислот обычно берем по объему, вычисленному по плотности.
Например, нужно приготовить 0,1 н. раствор H2S04. Это значит, что в 1 л раствора должно содержаться
Сколько же по объему нужно взять H2S04 с плотностью 1,84, чтобы, разбавив ее до 1 л, получить 0,1 н. раствор?
Кислота с плотностью 1,84 содержит 95,6% H2S04. Следовательно, на 1 л раствора ее нужно взять в граммах:
Выражая массу в объемных единицах, получим
Отмерив из бюретки точно 2,8 мл кислоты, разбавляем ее до 1 л в мерной колбе, затем, титруя щелочью, проверяем нормальность.
Например, при титровании установлено, что 1 мл 0,1 н. раствора H2S04 содержит не 0,0049 г H2S04, а 0,0051 г. Для вычисления количества воды, которое нужно добавить к 1 л кислоты, составляем пропорцию:
Следовательно, в этот раствор нужно добавить 41 мл воды. Но учитывая, что от исходного раствора было взято на титрование 20 мл, что составляет 0,02, то воды нужно брать меньше, т. е. 41-(41-0,02) =41-0,8 =40,2 мл. Это количество воды и добавляем из бюретки в колбу с раствором.
Приведенная выше работа при выполнении довольно кропотлива, поэтому можно готовить приблизительно точные растворы, вводя поправочный коэффициент, который применяют в работе при каждом титровании. При этом израсходованное число миллилитров раствора умножаем на поправочный коэффициент.
Поправочный коэффициент вычисляем по формуле
где V — объем испытуемого раствора, взятый для титрования;
kt — поправочный коэффициент раствора щелочи известной нормальности, по которому устанавливают титр вновь приготовленного раствора кислоты;
Ух— объем раствора щелочи известной нормальности, пошедший на титрование испытуемой кислоты.
Источник
Приготовление титрованного раствора NaOH
Грамм-эквивалент NaOH равен 40 г, следовательно, для приготовления 1 л 1 н. раствора требуется 40 г этого реактива. В 1 л 0,5 н. раствора соответственно должно содержаться 20 г, 0,1 н. — 4 г и т.д. Для приготовления раствора используют химически чистый реактив NaOH, растворяя его в дистиллированной воде в объеме, равном массе (весу) реактива, получая при этом насыщенный раствор NaOH.
Приготовленный раствор оставляют в склянке с резиновой пробкой на 2-3 недели для осаждения примеси карбоната натрия. После этого проверяют концентрацию полученного раствора путем титрования пробы определенного объема в присутствии индикатора метилового оранжевого. На основании полученных данных устанавливают необходимое количество насыщенного раствора NaOH для приготовления титрованного раствора.
Пример расчета. Требуется приготовить 10 л 0,1 н. раствора NaOH, для этого необходимо 10 X 4 = 40 г NaOH. Согласно проверке концентрации насыщенного раствора установлено, что в 1 л содержится 500 г NaOH. Следовательно, необходимые 40 г NaOH содержатся в следующем объеме (мл) насыщенного раствора:
Для приготовления 0,1 н. раствора необходимо взять 80 мл насыщенного раствора и довести дистиллированной водой (освобожденной от CO2 кипячением) до 10 л. Насыщенный раствор очень осторожно сливают с осадка сифоном.
Титрованный раствор щелочи хранят в склянке с пробкой, снабженной хлоркальциевой трубкой с натронной известью, для защиты от углекислого газа воздуха. Титр раствора щелочи устанавливают по янтарной кислоте или по титрованному раствору соляной кислоты.
Для установления титра 0,1 н. раствора NaOH по янтарной кислоте берут с точностью до 0,0001 г 3-4 навески химически чистой высушенной до постоянной массы (веса) кислоты по 0,20-0,25 г.
Навеску янтарной кислоты переносят в коническую колбу емкостью 250 мл и растворяют в 25-50 мл дистиллированной воды. Прибавляют к этому раствору 3-4 капли индикатора фенолфталеина и титруют раствором едкого натра до неисчезающего в течение 50-60 сек розового окрашивания. Коэффициент поправки К для титрованного раствора NaOH рассчитывают по следующей формуле:
где g — навеска янтарной кислоты, г; V — объем едкого натра, израсходованного на титрование, мл; 0,0059 — количество янтарной кислоты, соответствующее 1 мл точно 0,1 н. раствора NaCl.
Источник
Химические методы исследования свойств
Работа 2. Приготовление раствора гидроксида натрия и
установление его концентрации
Цель работы: освоить метод нейтрализации; ознакомиться с проведением расчетов и приготовлением растворов способом разбавления, приготовить раствор гидроксида натрия, установить его концентрацию.
Сущность работы. Раствор гидроксида натрия готовят способом разбавления. Титриметрическое определение его концентрации основано на реакции нейтрализации раствором кислоты: NaOH + HCl → NaCl + H 2 O. Фиксирование конечной точки титрования проводят с помощью кислотно-основного индикатора метилового оранжевого, который в щелочной среде имеет желтую окраску, в кислой – розовую. Титрование заканчивают при появлении оранжевой окраски раствора.
Оборудование и реактивы: бюретка вместимостью 25,00 см 3 ; мерные колбы вместимостью 100,00 см 3 ; колбы конические для титрования вместимостью 100–250 см 3 ; стакан для слива; мерный цилиндр вместимостью 10,00 см 3 ; мерная пипетка вместимостью 5–25 см 3 ; фиксанал HСl (0,1 моль); раствор NaOH, концентрированный; индикатор метиловый оранжевый, = 0,1%.
Методика выполнения анализа
1. Приготовление рабочего раствора гидроксида натрия.
Раствор гидроксида натрия готовят способом разбавления. Для этого рассчитывают объем концентрированного раствора, необходимый для приготовления 100 см 3 раствора с С экв (NaOH) = 0,1 моль/дм 3 . Сначала вычисляют массу по данным для разбавленного раствора:
где С экв (NaOH) – молярная концентрация эквивалентов раствора NaOH, моль/дм 3 ; М экв (NaOH) – молярная масса эквивалентов NaOH, г/моль; V м.к. – вместимость мерной колбы, дм 3 .
Такая же масса NaOH должна содержаться и в объеме концентрированного раствора, который будет взят для разбавления. Объем концентрированного раствора NaOH рассчитывают из формулы для вычисления массовой доли:
Вычисленный объем измеряют мерным цилиндром, переносят в мерную колбу, доводят раствор дистиллированной водой до метки по нижнему краю мениска, затем тщательно перемешивают.
2. Приготовление раствора HС l из фиксанала.
Фиксаналы – это изготовленные в заводских условиях стеклянные ампулы, содержащие определенное количество моль эквивалентов химически чистого вещества в сухом виде или в виде раствора. В данной работе используется фиксанал, содержащий HCl в количестве n экв = 0,1000 моль. Приготовление раствора из фиксанала сводится к тому, чтобы количественно перенести содержимое ампулы в мерную колбу определенной вместимости. Расчет объема мерной колбы ведут по формулам:
Находящиеся в коробке фиксаналы и бойки обязательно моют сначала водопроводной водой, а затем ополаскивают дистиллированной. В мерную колбу вставляют чистую воронку, опускают в нее боек с «воротничком» длинным концом вниз. Осторожно, легким ударом об этот боек пробивают тонкое дно фиксанала. Не изменяя положения ампулы над воронкой, вторым бойком пробивают верхнее углубление на ней. Содержимое ампулы выливается или высыпается в мерную колбу. Ампулу продолжают держать в том же положении. Тщательно ополаскивают внутреннюю поверхность ампулы струей из промывалки. После чего воронку и бойки промывают дистиллированной водой и вынимают их из колбы. Доводят до метки (по нижнему краю мениска) уровень раствора дистиллированной водой. Колбу плотно закрывают пробкой и тщательно перемешивают раствор.
3. Установление концентрации рабочего раствора гидроксида натрия.
Аликвотную часть раствора NaOH ( V ал.ч. ) отбирают мерной пипеткой, которую подготавливают следующим образом: маленький стаканчик ополаскивают раствором NaOH, затем наливают 1/3 стаканчика и ополаскивают пипетку этим раствором 2 – 3 раза. Выливают остатки раствора. Наливают свежий раствор, отбирают аликвотную часть, переносят в колбу для титрования, добавляют 1–2 капли индикатора метилового оранжевого и титруют приготовленным раствором HCl из бюретки до перехода окраски раствора из желтой в оранжевую. Записывают объем титранта с точностью до второго знака после запятой. Для повышения точности результатов анализа, титрование проводят 3 – 4 раза. В расчетную формулу подставляют среднее значение объема, при вычислении которого учитывают только те объемы, которые отличаются друг от друга не более, чем на 0,10 см 3 . Концентрацию раствора NaOH рассчитывают, используя выражение закона эквивалентов:
Работа 3. Определение аммиака в солях аммония методом
Цель работы : определить содержание аммиака в солях аммония методом обратного титрования.
Сущность работы. Аммониевые соли проявляют свойства очень слабых кислот, поэтому их прямое титрование невозможно; используют косвенные методы – метод обратного титрования или метод замещения. Определение аммиака методом обратного титрования проводят следующим образом: к раствору соли аммония добавляют точно измеренное количество щелочи в избытке. Часть щелочи вступает в реакцию:
Раствор кипятят до полного удаления аммиака. Избыток щелочи остается в растворе, его титруют раствором кислоты.
Зная количество щелочи, введенное в раствор соли аммония и оставшееся после удаления аммиака, вычисляют содержание аммиака.
Оборудование и реактивы : аналитические весы; бюретка вместимостью 25,00 см 3 ; бюретка вместимостью 50,00 см 3 ; мерная колба вместимостью 250,00 см 3 ; стакан вместимостью 150,00 см 3 ; колба коническая для титрования; мерный цилиндр вместимостью 10 см 3 ; мерная пипетка вместимостью 5 – 10 см 3 ; соляная кислота, C экв (HCl) 0,1 моль/дм 3 ; раствор NaOH, C экв (NaOH) 0,1 моль/дм 3 ; хлорид аммония, ч.д.а. или х.ч.; индикатор метиловый оранжевый; красная лакмусовая бумага.
Методика выполнения анализа
В колбе для титрования получают раствор соли аммония, добавляют точно отмеренный объем титрованного раствора NaOH (2030 см 3 ) и кипятят до полного удаления аммиака. Для проверки полноты удаления аммиака через некоторое время в пары вносят красную лакмусовую бумажку, смоченную в дистиллированной воде. Если аммиак удален полностью, лакмусовая бумажка не должна синеть. После полного удаления аммиака раствор охлаждают, ополаскивают внутренние стенки колбы дистиллированной водой и титруют раствором хлороводородной кислоты с индикатором метиловым оранжевым до перехода окраски раствора из желтой в оранжевую. При расчете массы аммиака в растворе соли аммония, используют формулу:
где С экв. (NaOH) – молярная концентрация эквивалентов раствора NaOH, моль/дм 3 ; V (NaOH) объем раствора NaOH, см 3 ; С экв. (HCl) – молярная концентрация эквивалентов раствора HCl, моль/дм 3 ; V (HCl) объем рабочего раствора, израсходованный на титрование, см 3 ; М экв. (NH 3 ) – молярная масса эквивалентов аммиака, г/моль.
Работа 4. Определение титруемой кислотности или
щелочности продовольственного сырья и пищевых продуктов
Цель работы: освоить методики определения показателей кислотности или щелочности сырья и пищевых продуктов.
Сущность работы. Кислотность продовольственного сырья и пищевых продуктов обусловлена наличием в них различных пищевых кислот (уксусная, молочная, яблочная, лимонная, винная) или их кислых солей. Для фиксирования точки эквивалентности используют индикатор – фенолфталеин.
Щелочность определяют в изделиях, приготовленных с введением щелочных химических разрыхрытелей (гидрокарбоната натрия, карбоната аммония). При титровании водной вытяжки из навески мучных кондитерских изделий в качестве индикатора используют бромтимоловый синий.
Оборудование и реактивы: бюретка вместимостью 25,00 см 3 ; колба для титрования вместимостью 100 см 3 или 250 см 3 ; пипетка вместимостью 10,00 см 3 ; раствор гидроксида калия (или гидроксида натрия), С осн. = 0,1000 моль/дм 3 ; хлороводородная или серная кислота; С к-ты = 0,1000 моль/дм 3 ; индикаторы – фенолфталеин, бромтимоловый синий; гептагидрат сульфата кобальта,
СоSO 4 · 7H 2 O, ч.д.а.
Методика выполнения анализа
1. Определение титруемой кислотности молока.
Кислотность молока и молочных продуктов обусловлена наличием в них молочной кислоты, гидрофосфатов и гидрокарбонатов. Повышение кислотности вызывает нежелательные изменения свойств молока, одно из которых – снижение устойчивости белков к нагреванию, поэтому молоко с кислотностью 21 °Т принимают как несортовое, а молоко свыше 22 °Т не подлежит сдаче на молочные заводы.
Кислотность молока и молочных продуктов выражают в градусах Тернера (°Т) (объем раствора щелочи с молярной концентрацией 0,1000 моль/дм 3 , израсходованный на титрование 100,00 см 3 молока или 100 г молочного продукта).
Источник