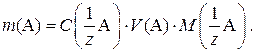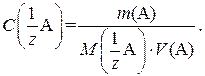Приготовление и стандартизация рабочих растворов метода кислотно-основного титрования
Цель работы: приготовить и стандартизировать рабочие растворы метода кислотно-основного титрования – HCl и NaOH (или KOH).
Сущность работы. Для проведения титриметрического определения необходимо прежде всего приготовить стандартный (рабочий) раствор титранта.
Стандартные растворы готовят с использованием аналитических весов и точной мерной посуды (бюретки, пипетки, мерные колбы). Концентрацию их записывают с точностью до четвертой значащей цифры.
Классификация стандартных растворов и все возможные способы их приготовления представлены на схеме.
| Стандартные растворы | |||
| ¯ | ¯ | ||
| Первичные (приготовленные) | Вторичные (установленные) | ||
| ¯ | ¯ | ¯ | ¯ |
| Из стандартного исходного вещества | Из фиксанала | Из кристаллического вещества | Из более концентрированного раствора |
Первичный стандартный раствор можно приготовить сразу с точно известной концентрацией и не стандартизировать.
Способы приготовления первичных стандартных растворов:
1 .Из кристаллического стандартного вещества (установочного вещества, исходного вещества, первичного стандарта). Взвешивают на аналитических весах точную навеску стандартного вещества, переносят в мерную колбу, растворяют в дистиллированной воде, затем доводят до метки (рис. 20).
Рис. 20. Приготовление первичного стандартного раствора
из кристаллического стандартного вещества
Ориентировочную массу навески вещества для приготовления раствора рассчитывают по формуле
После взятия навески и ее растворения в мерной колбе рассчитывают точную концентрацию приготовленного раствора по формуле
Кристаллическое вещество для приготовления первичного стандартного раствора должно соответствовать ряду требований:
– состав вещества должен строго соответствовать его формуле;
– вещество должно быть устойчиво на воздухе (не должно окисляться, поглощать СО2, Н2О) при хранении в твердом состоянии и в растворе;
– вещество должно быть хорошо растворимым, нелетучим, желательно безводным;
– вещество должно быть чистым (квалификации не ниже «х. ч.» или «ч. д. а», см. &);
– вещество должно легко очищаться от примесей перекристаллизацией;
– вещество должно иметь большую молярную массу эквивалента (тогда ошибка при взятии навески будет меньше);
– вещество должно быть доступным и недорогим.
Если взять такое вещество, взвесить его на аналитических весах и растворить в мерной колбе, то получится первичный стандартный раствор.

Поскольку чаще всего в ампуле содержится 0,1 моль-экв вещества, то концентрацию стандартного раствора, приготовленного из фиксанала в мерной колбе вместимостью V, находят по формуле
Вторичный стандартный растворготовят в два этапа.
1. Готовят раствор с примерно известной концентрацией из кристаллического вещества или из более концентрированного раствора, используя технические весы и мерную посуду с ориентировочными делениями (мерные цилиндры, стаканы с делениями).
2. Определяют его точную концентрацию (стандартизируют) путем титрования первичного стандартного раствора.
В лабораторной работе рабочие растворы HCl и NaOH готовят как вторичные стандарты путем разбавления более концентрированных растворов с последующей стандартизацией по первичным стандартным растворам тетрабората натрия Na2B4O7 ∙ 10H2O и щавелевой кислоты Н2С2O4 ×2H2O. При титровании протекают следующие реакции:
(fэкв(Na2B4O7) = 
(fэкв(Н2С2O4) = 
Концентрацию растворов установочных веществ задают близкой к концентрации рабочих растворов.
Оборудование и реактивы: технические и аналитические весы, электрическая плитка, мерные цилиндры (10–25 мл, 250 мл), стаканы с делениями (500 мл), денсиметр (ареометр), склянки с этикетками для хранения рабочих растворов, мерная колба, пипетка, бюретка, колбы для титрования, тигель, Na2B4O7 ×10H2O (х. ч.), Н2С2O4 ×2H2O (х. ч.), концентрированные растворы HCl и NaOH (или KOH), индикаторы метиловый оранжевый и фенолфталеин.
Выполнение работы
1. Приготовление разбавленных растворов HCl и NaOH:
– с помощью денсиметров измеряют плотности концентрированных растворов HCl и NaOH;
– по справочнику находят их молярные концентрации (моль/л);
– рассчитывают объемы концентрированных растворов HCl и NaOH, необходимые для приготовления 500 мл (или 300 мл по указанию преподавателя) 0,1 н. растворов;
– цилиндрами отмеряют рассчитанные объемы HCl и NaOH, переносят их в стаканы вместимостью 500 мл и разбавляют дистиллированной водой до нужного объема;
– приготовленные растворы HCl и NaOH переливают в подписанные склянки для хранения, закрывают пробками и тщательно перемешивают.
Приготовленные растворы HCl и NaOH имеет приблизительно известную концентрацию, поэтому их необходимо стандартизировать.
2. Приготовление первичного стандартного раствора Na2B4O7:
– рассчитывают ориентировочную массу установочного вещества Na2B4O7 ×10H2O, необходимую для приготовления 100 мл 0,1 н. раствора;
– установочное вещество взвешивают в тигле на технических, а затем на аналитических весах;
– навеску аккуратно пересыпают через воронку в мерную колбу, тигель с оставшимися на стенках частицами Na2B4O7 ×10H2O снова взвешивают на аналитических весах;
– по разности двух взвешиваний на аналитических весах находят массу Na2B4O7 ×10H2O, перенесенного в колбу;
– смывают навеску в колбу струей горячей дистиллированной воды, заполняют колбу на 2/3 объема водой. Снимают с колбы воронку и, перемешивая содержимое колбы круговыми движениями, добиваются полного растворения Na2B4O7 ×10H2O. Затем доводят содержимое колбы до метки дистиллированной водой и тщательно перемешивают раствор, многократно переворачивая колбу;
– вычисляют молярную концентрацию эквивалента Na2B4O7 с точностью до четвертой значащей цифры и приступают к титрованию.
3. Установление точной концентрации приготовленного раствора HCl (стандартизация):
– вымытую бюретку ополаскивают небольшим количеством приготовленного рабочего раствора HCl и заполняют ее этим раствором;
– в чистую коническую колбу переносят пипеткой определенный объем (аликвоту) приготовленного раствора установочного вещества Na2B4O7, прибавляют 1–2 капли индикатора метилового оранжевого и начинают титровать, перемешивая жидкость круговым движением колбы. Титрование прекращают, как только произойдет резкое изменение окраски раствора;
– титрование повторяют несколько раз, пока не будет получено не менее трех значений объема титранта, различающихся между собой не более чем на 0,1 мл. Все полученные результаты должны обязательно заноситься в лабораторный журнал, даже если они и одинаковые.
– рассчитывают средний объем титранта, учитывая только те значения, которые различаются не более чем на 0,1 мл;
– по результатам титрования находят точную молярную концентрацию эквивалента приготовленного рабочего раствора HCl.
В некоторых случаях по указанию преподавателя рабочий раствор HCl может быть приготовлен из фиксанала или установление концентрации его может быть проведено по стандартному раствору щелочи, Na2CO3 или NaHCO3.
4. Приготовление первичного стандартного раствора Н2С2O4:
– рассчитывают ориентировочную массу установочного вещества Н2С2O4×2H2O, необходимую для приготовления 100 мл 0,1 н. раствора;
– установочное вещество взвешивают в тигле на технических, а затем на аналитических весах;
– навеску аккуратно пересыпают через воронку в мерную колбу, тигель с оставшимися на стенках частицами Н2С2O4×2H2O снова взвешивают на аналитических весах;
– по разности двух взвешиваний на аналитических весах находят массу Н2С2O4×2H2O, перенесенной в колбу;
– смывают навеску в колбу струей дистиллированной воды, заполняют колбу на 2/3 объема водой. Снимают с колбы воронку и, перемешивая содержимое колбы круговыми движениями, добиваются полного растворения Н2С2O4×2H2O. Затем доводят содержимое колбы до метки дистиллированной водой и тщательно перемешивают раствор, многократно переворачивая колбу;
– вычисляют молярную концентрацию эквивалента Н2С2O4 с точностью до четвертой значащей цифры и приступают к титрованию.
5. Установление точной концентрации приготовленного раствора NaOH (стандартизация):
– вымытую бюретку ополаскивают небольшим количеством приготовленного рабочего раствора NaOH и заполняют ее этим раствором;
– в чистую коническую колбу переносят пипеткой определенный объем (аликвоту) приготовленного раствора установочного вещества Н2С2O4, прибавляют 1–2 капли индикатора фенолфталеина и начинают титровать, перемешивая жидкость круговым движением колбы. Титрование прекращают, как только появится неисчезающая розовая окраска раствора;
– титрование повторяют несколько раз, пока не будет получено не менее трех значений объема титранта, различающихся между собой не более чем на 0,1 мл. Все полученные результаты должны обязательно заноситься в лабораторный журнал, даже если они и одинаковые;
– рассчитывают средний объем титранта, учитывая только те значения, которые различаются не более чем на 0,1 мл;
– по результатам титрования находят точную молярную концентрацию эквивалента приготовленного рабочего раствора NaOH.
В некоторых случаях по указанию преподавателя рабочий раствор NaOH может быть приготовлен из фиксанала или установление концентрации его может быть проведено по стандартному раствору HCl.
Источник
§ 69. Приготовление рабочего титрованного раствора HCl
бодной борной кислотой н3во3, величина рН раствора определяется, очевидно, присутствием H3BO3. Пренебрегая изменением объема при титрованииО,1 н.раствора тетрабората и учитывая, что р/С борной кислоты равен 9,24, находим рН в точке эквивалентности:
РН = у рКк„сл — у Ig Скисл = -у- + 0,5 = 5,12
Следовательно, для титрования лучше всего подойдет метиловый красный с рТ = 5,5. Можно титровать тетраборат и с метиловым оранжевым, так как его показатель титрования (рТ = 4) не выходит за пределы скачка рН на кривой титрования (р’Н= = 4,0-6,2).
Приготовление раствора тетрабората натрия. Сначала рассчитывают величину навески, необходимой для приготовления раствора в мерной колбе емкостью 250 мл (или 200 мл).
Так как 1 моль (381,4 г) Na2B4O7-IOH2O реагирует с 2 моль HCl, т. е. с 2 г-ион водорода, 1 г-экв его равен 381,4:2= 190,7 г. Для получения 1 л 0,1 н. раствора потребуется, следовательно, 19,07 г, а для 250 мл 19,07:4, т. е. 4,7875 г тетрабората натрия.
Брать на аналитических весах вычисленное количество тетрабората натрия не имеет смысла, так как это не дает никаких преимуществ, а времени отнимает много. Поэтому, поместив в бюкс (или на часовое стекло) предварительно отвешенное на технических весах количество тетрабората натрия (4—5 г), точно взвешивают бюкс с веществом на аналитических весах. Далее осторожно пересыпают тетраборат натрия через сухую воронку* в тщательно вымытую мерную колбу. Бюкс с оставшимися в нем крупинками тетрабората натрия снова точно взвешивают и по разности находят массу тетрабората натрия, насыпанного в колбу. Струей горячей воды из промывалки (в холодной воде тетраборат натрия растворяется плохо) хорошо смывают тетраборат натрия из воронки в колбу 1
Добавляют еще столько горячей воды в колбу, чтобы она была заполнена на 2/з объема, вынимают воронку и, перемешивая содержимое колбы плавными круговыми движениями, растворяют тетраборат натрия. После этого раствор охлаждают до комнатной температуры и разбавляют его до метки дистиллированной водой. Под конец воду добавляют по каплям до тех пор, пока нижний край мениска не окажется на уровне метки. Приготовленный раствор тщательно перемешивают, много раз перевертывая и встряхивая колбу, предварительно закрыв ее пробкой. Приготовив таким образом раствор тетрабората натрия, вычисляют титр и нормаль-
* К мокрой воронке вещество прилипает и плотно забивает ее трубку. Лучше употреблять специальные воронки для порошков с широкой и короткой трубкой (или обыкновенные воронки с отрезанной трубкой).
ность его. Для нахождения титра величину навески (взятой, как описано выше) делят на объем * раствора.
Например, если навеска тетрабората натрия равнялась 4,6812 г, то:
Чтобы от найденного титра перейти к нормальности, его умножают на 1000 (для пересчета на 1 л) и делят на величину грамм-эквивалента:
Безводный карбонат натрия также часто применяется для установки титра кислоты. Его можно получить из химически чистого бикарбоната натрия путем прокаливания при 270—3000C или из перекристаллизованного оксалата натрия, который при прокаливании превращается в карбонат:
Na2C2O4 —*■ Na2CO3 + СО
Обычно Na2CO3 содержит небольшое количество влаги, поэтому перед употреблением его нужно прокалить в электрической печи при 270—3000C до постоянной массы. Титрование Na2CO3 рассмотрено выше (см. § 65), следует только учесть, что при титровании по метиловому оранжевому в растворе накапливается СОг и конец титрования может быть не очень отчетливым. Для получения отчетливого изменения цвета индикатора нужно титруемый раствор в конце титрования прокипятить 1—2 мин для удаления CO2, охладить и закончить титрование. При использовании в качестве исходного вещества HgO в раствор вводят избыток Br», при этом происходит реакция:
HgO+ 4Br» +H2O —► [HgBr4]2″+ 2OH-
-ионы титруют кислотой с любым индикатором, рТ которого лежит в интервале 4—8. KIO3 может быть применен для установки титра кислот, так как в растворе, содержащем Юз и I», протекает реакция:
Ю» + 5Г + 6Н+ —> 3I2 + 3H2O
К точному объему титрованного раствора KIO3 добавляют в избытке KI и Na2S2O3 для связывания I2:
2S2O2″ + L —V S4O2″+ 21″
* Конечно, если при проверке емкости мерной колбы (см. § 51) было найдено, что емкость ее не равна 250,0 мл, то при вычислении следует употреблять ее действительную, т. е. найденную на опыте, емкость. То же относится и к емкости пипетки.
затем метиловый оранжевый и титруют кислотой. Пока в растворе есть Юз цвет индикатора изменяться не будет, но как только весь иодат прореагирует, лишняя капля кислоты изменит цвет метилового оранжевого.
Приготовление раствора соляной кислоты. Один литр 0,1 н. раствора соляной кислоты содержит 3,646 г (или округленно 3,6 г) HCl. Сначала вычисляют, в каком объеме концентрированной соляной кислоты (плотность 1,19 г/см3) содержится такое количество HCl. Для расчета пользуются таблицей плотностей растворов сильных кислот и щелочей, по которой находят, что соляная кислота плотностью 1,19 г/см3 содержит
Отсюда можно составить пропорцию:
в 100 г раствора HCl содержится 38 г HCl вхв » HCl » 3,6 г HCl
Для пересчета найденного весового количества кислоты на объем (V) ее нужно вычисленное количество поделить на плотность кислоты (1,19 г/см3). Таким образом
V = 9,6:1,19 = 8,1 мл
Приблизительно отмерив вычисленный объем (8—9 мл) концентрированной HCl при помощи маленькой мензурки, разбавляют кислоту дистиллированной водой до 1 л в большом мерном цилиндре. Полученный раствор тщательно перемешивают.
Титрование. Приготовив нужные растворы, приступают к титрованию. Бюретку тщательно моют и под конец ополаскивают 2 раза небольшим количеством приготовленного раствора HCl1 чтобы удалить из нее остаток воды. После этого бюретку наполняют почти доверху раствором HCl; затем, подставив под нее колбу или стакан и приоткрыв зажим, заполняют оттянутую трубку бюретки так, чтобы в ней не оставалось пузырьков воздуха.
Далее в чистую коническую колбу переносят тщательно вымытой пипеткой 25,00 мл приготовленного титрованного раствора тетрабората натрия, предварительно дважды ополоснув пипетку этим же раствором. К раствору тетрабората натрия прибавляют одну или самое большее две капли раствора метилового оранжевого.
В другой такой же колбе готовят свидетель. Для этого мензуркой отмеривают 50 мл дистиллированной воды, добавляют 1—2 капли метилового оранжевого и 1 каплю кислоты из бюретки так, чтобы появилось слабо-розовое окрашивание раствора *. После этого устанавливают уровень раствора HCl в бюретке на нуле.
* Можно готовить свидетель и без HCl. Он будет иметь чисто-желтую окраску, при сравнении с которой легко заметить перемену окраски титруемого раствора. Еще лучше иметь оба свидетеля.
Колбу с раствором тетрабората натрия ставят под бюретку на лист белой бумаги и понемногу приливают из бюретки раствор HCl, непрерывно перемешивая жидкость плавным круговым движением колбы. Нужно уловить момент, когда от одной капли соляной кислоты первоначально чисто-желтый раствор приобретет чуть розоватый оттенок — как раз такой, как у приготовленного свидетеля.
Точно уловить этот момент при первом титровании трудно. Поэтому сначала устанавливают нужный объем кислоты приблизительно с точностью до 1 мл. Например, при первом титровании было найдено,-что при 23,00 мл HCl окраска раствора была еще желтой, а при 24,00 мл она стала ярко-розовой. В таком случае, повторяя титрование с новой порцией раствора тетрабората натрия, 23,00 мл кислоты можно влить уже смело *. В дальнейшем раствор HCl прибавляют по каплям.
Если возникает сомнение, переменилась ли окраска раствора, делают отсчет по бюретке (см. ниже), после чего добавляют еще каплю раствора HCl. Если перемена окраски действительно произошла, то прибавленная капля вызовет очень явственное порозовение раствора и, следовательно, будет уже лишней. Конечно, принимать во внимание эту лишнюю каплю не следует.
Добившись перемены окраски от одной капли соляной кислоты, делают отсчет по бюретке и записывают его.
Если нижний край мениска не совпадает с тем или иным делением бюретки, на глаз определяют число сотых долей миллилитра.
При всех отсчетах необходимо, чтобы глаза наблюдателя были на уровне мениска.
Точное титрование следует повторить по крайней мере трижды, каждый раз беря новую порцию раствора и устанавливая уровень жидкости в бюретке на нуле. При хорошей работе разница в отсчетах получается в сотых долях миллилитра. Во всяком случае она не должна превышать 0,1 мл. Если наблюдаются большие расхождения, титрование повторяют до получения трех сходящихся в пределах одной капли результатов, из которых берут среднее. Все полученные отсчеты следует обязательно заносить в лабораторный журнал, хотя бы они и были одинаковыми.
Вычисление титра раствора соляной кислоты. Рассмотрим ход вычислений на примере. На титрование 25,00 мл раствора тетрабората натрия, нормальность которого равна 0,09504, израсходо-
* Поскольку титрование проводят всегда несколько раз, то удобно сразу в 3—4 конические колбы отмерить по 25 мл раствора тетрабората натрия и титровать эти растворы последовательно. Если почему-либо работают с одной конической колбой, то, конечно, перед тем как брать пипеткой новую порцию раствора тетрабората натрия нужно жидкость из колбы вылить, а самую колбу хорошо ополоснуть сначала водопроводной, а под конец дистиллированной водой. Уровень жидкости в бюретке необходимо снова установить на нуле.
вано 23,40; 23,20; 23,28 и 23,20 мл раствора HCl. Отбросив сильно отклонившуюся величину (23,40), находят среднее:
„ 23,20 + 23,28 + 23,20
где Уна — среднее из отсчетов.
Обозначив искомую нормальность раствора HCl через JV и пользуясь выведенным выше правилом, согласно которому произведения из объемов растворов на их нормальность должны быть одинаковыми для обоих реагирующих веществ, можно написать:
23,23JV = 25,00 • 0,09504
Полученная величина N вполне характеризует концентрацию раствора HCl и является достаточной для вычисления результатов анализов. Поэтому никаких других вычислений здесь можно не делать. Если потребовалось бы найти также титр раствора HCl, то для этого нужно найденную нормальность его умножить на грамм-эквивалент HCl, т. е. на 36,46 г, и поделить на 1000:
0,1023-36,46 „„.,„ . ?HC1 = 23)23 = °-003729 г1МЛ
Все эти вычисления нужно делать, пользуясь таблицами четырехзначных логарифмов и антилогарифмов, с точностью, отвечающей точности анализа (т. е. до четырех значащих цифр). Наоборот, вычисления объемов концентрированной соляной кислоты при приготовлении ее растворов являются приближенными, и потому все соответствующие величины целесообразно округлять.
Источник