- Инструкция по применению нитрита натрия при посоле мясных продуктов
- Применение нитрита натрия при посоле мясопродуктов (говядины, свинины, баранины и конины)
- Применение нитрита натрия при изготовлении колбасных фабрикатов
- Контроль готовой продукции
- Приложение А (обязательное). Методика приготовления аттестованных растворов нитрита натрия
- 1. Приготовление и стандартизация 0,1 м NaNo2
- 2. Нитритометрическое определение стрептоцида
- Занятие 25
- Цель занятия
Инструкция по применению нитрита натрия при посоле мясных продуктов
1. Нитрит натрия (NaNO2) применяется при посоле мясопродуктов и при изготовлении колбасных фабрикатов для придания этим продуктам розово-красного цвета.
2. Применение нитрита при посоле мясопродуктов и изготовлении колбас должно быть в определенных дозах и находиться под постоянным надзором со стороны техно-химического контроля предприятий и саннадзора, так как нитрит натрия вреден для организма человека даже в небольших количествах.
3. Необходимо обеспечить равномерное распределение нитрита в мясопродуктах, что может быть достигнуто при употреблении его в минимальных количествах в виде растворов. Применение нитрита натрия в сухом виде как путем непосредственного добавления, так и в смеси с сухой солью, не допускается.
4. Нитрит натрия применяется лишь на тех предприятиях мясной промышленности, которые обеспечены лабораторным контролем. При этом хранение и дозировка нитрита натрия должны находиться под постоянным надзором и ответственностью заводской лаборатории и саннадзора.
Применение нитрита натрия при посоле мясопродуктов (говядины, свинины, баранины и конины)
Для посола говядины, свинины, баранины и конины нитрит натрия может применяться взамен селитры только при мокром и смешанном способе посола.
а) Мокрый способ посола (со шприцеванием и без шприцевания). Предварительно отвешенное потребное количество нитрита натрия растворяется в небольшом количестве воды, затем этот раствор добавляется в рассол и все тщательно перемешивается. Дозировка нитрита натрия как для шприцовочного рассола, так и для заливочного — одинаковая.
При посоле означенным способом говядины, баранины и конины нитрит натрия добавляется в дозе 0,10% к весу рассола или 0,12% к объему рассола, а при посоле свинины — 0,08% к весу или 0,08% к объему рассола. Непременным условием при применении указанных дозировок является количество шприцовочного и заливочного рассола, употребляемое при посоле, а именно: для шприцевания 10—12% к весу мяса (для заливки — 50% к весу мяса).
б) Смешанный способ посола. При смешанном способе посола, применяемом для засола говядины, свинины и баранины, мясо сначала натирается солью и на 3-й день от начала посола заливается рассолом, в который вводится нитрит натрия. Последний добавляется в количестве 0,10% к весу рассола или 0,12% к объему его, причем количество рассола для доливки берется с таким расчетом, чтобы вместе с маточным рассолом (образовавшимся в первые 3 дня посола из мяса) оно составляло 50% к весу засаливаемого мяса.
Применение нитрита натрия при изготовлении колбасных фабрикатов
1. Нитрит натрия при изготовлении колбасных фабрикатов добавляется в виде водного раствора к третированному мясу или фаршу при одновременном перемешивании их.
2. Количество нитрита натрия должно составлять при изготовлении колбас не более 0,005% к весу третированного мяса или мяса, пропущенного через волчок.
3. Растворы нитрита натрия изготовляются и хранятся в лаборатории не более 1 суток.
4. Нитрит натрия в виде водного раствора находится при посоле шротированного мяса в замесе фарша в месилке непосредственно после начала работы ее.
5. Для обеспечения равномерности распределения нитрата натрия в мясе и фарше водный раствор его вводится постепенно через лейки с мелкими отверстиями.
6. Продолжительность перемешивания шротированного мяса в месилке не должна быть менее 4 мин., продолжительность же смешивания фарша в месилке не должна быть менее 15 мин.
Контроль готовой продукции
Из каждой партии засоленного мяса или приготовленных колбас берется проба в количестве, определяемом по стандарту для проведения техно-химического контроля. Пробы подвергаются анализу на определение содержания в них свободного нитрита натрия методом Грисса. В готовой продукции содержание нитритов не допускается свыше 20 мг на 100 г мяса.
Источник
Приложение А (обязательное). Методика приготовления аттестованных растворов нитрита натрия
Методика
приготовления аттестованных растворов нитрита натрия
, и
А.1. Назначение и область применения
Методика приготовления аттестованных растворов нитрита натрия разработана в соответствии с РМГ 60 и регламентирует процедуру, предназначенную для установления градуировочных зависимостей и контроля точности результатов измерения массовой концентрации нитрит-ионов фотометрическим методом.
А.2. Метрологические характеристики
А.2.1. Метрологические характеристики аттестованных растворов приведены в таблице А.1.
Значение характеристики для аттестованного раствора
Аттестованное значение массовой концентрации нитрит-ионов,
Границы погрешности установления аттестованного значения массовой концентрации нитрит-ионов, (P = 0,95),
А.3. Требования к средствам измерений, вспомогательным устройствам, материалам и реактивам
А.3.1. Требования к средствам измерений, вспомогательным устройствам приведены в разделе 5.
А.3.2. При приготовлении аттестованных растворов применяют реактивы, указанные в таблице А.2.
Натрий азотистокислый (нитрит натрия)
х.ч., содержание основного вещества не менее 99%
А.4. Приготовление аттестованных растворов нитрита натрия
А.4.1. Приготовление аттестованного раствора
Взвешивают с точностью до четвертого знака после запятой 0,150 г нитрита натрия, предварительно высушенного при 60°С в течение 2 ч, количественно переносят в мерную колбу вместимостью 100 , растворяют в дистиллированной воде, доводят уровень раствора до метки дистиллированной водой, тщательно перемешивают. Полученному раствору приписывают массовую концентрацию нитрит-ионов 1000 .
А.4.2. Приготовление аттестованного раствора
Для приготовления раствора — 1 раствора переносят в мерную колбу вместимостью 100 , доводят до метки дистиллированной водой. Полученному раствору приписывают массовую концентрацию нитрит-ионов 10 .
А.4.3. Приготовление аттестованного раствора
Для приготовления раствора 10 раствора отбирают пипеткой с одной меткой, переносят его в мерную колбу вместимостью 100 , доводят до метки дистиллированной водой. Полученному раствору приписывают массовую концентрацию нитрит-ионов 1 .
А.4.4. Расчет метрологических характеристик аттестованных растворов
А.4.4.1. Аттестованное значение массовой концентрации нитрит-ионов в растворе , , рассчитывают по формуле
где m — масса навески нитрита натрия, г;
46,0 — молярная масса нитрит-ионов, г/моль;
V — вместимость мерной колбы, ;
69 — молярная масса нитрита натрия, г/моль.
А.4.4.2. Аттестованное значение массовой концентрации нитрит-ионов в растворе , , рассчитывают по формуле
где — значение массовой концентрации нитрит-ионов, приписанное раствору ;
— значение массовой концентрации нитрит-ионов, приписанное аттестованному раствору ;
— номинальный объем раствора с концентрацией , отбираемого пипеткой, ;
— вместимость мерной колбы, .
А.4.4.3. Аттестованное значение массовой концентрации нитрит-ионов в растворе , , рассчитывают по формуле
где — значение массовой концентрации нитрит-ионов, приписанное раствору ;
— значение массовой концентрации нитрит-ионов, приписанное аттестованному раствору ;
— номинальный объем раствора с концентрацией , отбираемого пипеткой, ;
— вместимость мерной колбы, .
А.4.4.4. Расчет предела возможных значений погрешности приготовления аттестованного раствора , , , выполняют по формуле
где — приписанное раствору значение массовой концентрации нитрит-ионов, ;
— предельное значение возможного отклонения массовой доли основного вещества в реактиве от приписанного значения ;
— массовая доля активного вещества в реактиве, приписанная реактиву квалификации, х.ч., %;
— предельная возможная погрешность взвешивания, г;
m — масса навески нитрита натрия, г;
— предельное значение возможного отклонения вместимости мерной колбы от номинального значения, ;
V — вместимость мерной колбы, .
Предел возможных значений погрешности приготовления аттестованного раствора равен
А.4.4.5. Расчет предела возможных значений погрешности приготовления аттестованного раствора , , , выполняют по формуле
где — приписанное раствору значение массовой концентрации нитрит-ионов, ;
— предел возможных значений погрешности приготовления аттестованного раствора с массовой концентрацией , ;
— приписанное раствору значение массовой концентрации нитрит-ионов, ;
— предельное значение возможного отклонения объема от номинального значения, ;
— объем раствора , отбираемый пипеткой, ;
— предельное значение возможного отклонения вместимости мерной колбы от номинального значения, ;
— вместимость мерной колбы, .
Предел возможных значений погрешности приготовления аттестованного раствора равен
А.4.4.6. Расчет предела возможных значений погрешности приготовления аттестованного раствора , , выполняют по формуле
где — приписанное раствору значение массовой концентрации нитрит-ионов, ;
— предел возможного значения погрешности приготовления аттестованного раствора — с массовой концентрацией , ;
— приписанное раствору значение массовой концентрации нитрит-ионов, ;
— предельное значение возможного отклонения объема от номинального значения, ;
— объем раствора , отбираемого пипеткой, ;
— предельное значение возможного отклонения вместимости мерной колбы от номинального значения, ;
— вместимость мерной колбы, .
Предел возможных значений погрешности приготовления аттестованного раствора равен
A.5. Требования безопасности, охраны окружающей среды
Требования безопасности приведены в разделе 7.
А.6. Требования к квалификации операторов
Требования к квалификации операторов приведены в разделе 8.
А.7. Требование к упаковке и маркировке
Аттестованные растворы помещают в колбу с пришлифованной пробкой. На колбу наносят маркировку с указанием массовой концентрации нитрит-ионов и даты приготовления.
А.8. Условия хранения
А.8.1. Аттестованный раствор хранят в герметично закрытой склянке в холодильнике в течение 7 сут при температуре от 4°С до 6°С.
А.8.2. Аттестованные растворы и готовят непосредственно перед применением.
Откройте актуальную версию документа прямо сейчас или получите полный доступ к системе ГАРАНТ на 3 дня бесплатно!
Если вы являетесь пользователем интернет-версии системы ГАРАНТ, вы можете открыть этот документ прямо сейчас или запросить по Горячей линии в системе.
Источник
1. Приготовление и стандартизация 0,1 м NaNo2
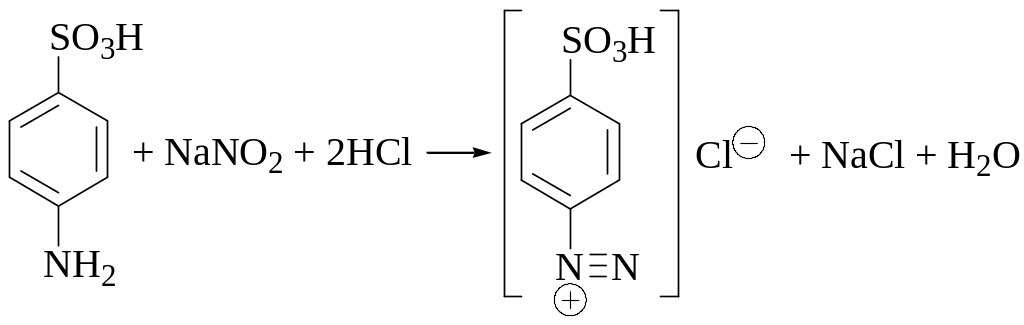
Стандартный раствор нитрита натрия является вторичным. Для его стандартизации обычно используют сульфаниловую (4-аминобензолсульфоновую) кислоту.
Нитритометрическое титрование следует проводить медленно. Вначале титрант прибавляют со скоростью 2 мл в минуту, а в конце титрования (примерно за 0,5 мл до эквивалентного количества) — 1 капля в минуту.
Приготовление и стандартизацию раствора нитрита натрия проводят по следующей методике. Навеску NaNO2 (около 0,7 г) помещают в химический стакан, добавляют к ней с помощью мерного цилиндра 100 мл воды и перемешивают.
В колбу для титрования помещают точную навеску сульфаниловой кислоты (около 0,2 г), прибавляют 0,1 г NaHCO3, 50 мл воды, 10 мл 4 М HCl, 5 мл 10% раствора KBr, 4 капли раствора тропеолина 00 и 2 капли раствора метиленового синего и медленно(!) титруют приготовленным раствором NaNO2 до перехода окраски от красно-фиолетовой к голубой.
Расчёт молярной концентрации NaNO2 в стандартизируемом растворе проводят по следующей формуле
где молярная масса сульфаниловой кислоты — M(СК) = 173,19 г/моль
2. Нитритометрическое определение стрептоцида
Стрептоцидом называют амид сульфаниловой кислоты. Его нитритометрическое определение проводится по такой же методике, что и для сульфаниловой кислоты.
В колбу для титрования помещают точную навеску анализируемого образца стрептоцида (около 0,25 г), прибавляют 50 мл воды, 10 мл 4 М HCl, 5 мл 10% раствора KBr, 4 капли раствора тропеолина 00 и 2 капли раствора метиленового синего и медленно титруют раствором NaNO2 до перехода окраски от красно-фиолетовой к голубой.
Расчёт массовой доли стрептоцида в анализируемом препарате проводят по следующей формуле
где М(стр) = 172,21 г/моль
Титр 0,1000 М NaNO2 по стрептоциду равен 0,1000172,2110 -3 = 1,72210 -2 г/мл. Таким образом
где k — поправочный коэффициент для раствора нитрита натрия.
Занятие 25
Цель занятия
общую характеристику, титранты и стандартные вещества, условия выполнения и практическое применение броматометрического, дихроматометрического, перманганатометрического и цериметрического титрования.
проводить стандартизацию раствора перманганата калия;
выполнять перманганатометрическое определение пероксида водорода.
Броматометрическое титрование. Принцип метода. Условия проведения титрования. Титранты и стандартные вещества. Обнаружение конечной точки титрования. Практическое применение.
Дихроматометрическое титрование. Принцип метода. Условия проведения титрования. Титранты и стандартные вещества. Обнаружение конечной точки титрования. Практическое применение.
Перманганатометрическое титрование. Принцип метода. Условия проведения титрования. Титранты и стандартные вещества. Обнаружение конечной точки титрования. Практическое применение.
Цериметрическое титрование. Принцип метода. Условия проведения титрования. Титранты и стандартные вещества. Обнаружение конечной точки титрования. Практическое применение.
Какой из вариантов броматометрического титрования иногда называют бромометрией? Почему для титрования удобнее использовать бромид-броматную смесь, а не стандартный раствор брома?
Броматометрическое титрование используется для количественного определения различных фенолов. Какие из фенолов, формулы которых приведены ниже, не могут быть определены броматометрически по реакции бромирования и почему?
Броматометрическое титрование, в основе которого лежит взаимодействие органических веществ с бромом, используется для косвенного определения катионов некоторых металлов. Вначале определяемый ион осаждают в виде малорастворимого комплекса с соответствующим органическим лигандом, например 8-гидроксихинолином. Затем осадок отфильтровывают, растворяют в хлороводородной кислоте и определяют вошедший в состав осадка органический лиганд броматометрически:
Рассчитайте фактор эквивалентности при таком определении для ионов Mg 2+ и Al 3+ , если первый взаимодействует с 8-гидроксихинолином в молярном соотношении 1:2, а второй — 1:3.
Назовите как можно больше преимуществ дихроматометрического титрования перед перманганатометрическим. Какая проблема может возникнуть при визуальном определении конечной точки дихроматометрического титрования?
Перманганатометрические определения в сильнощелочной среде часто проводят в присутствии катионов Ba 2+ . Почему в присутствии этих ионов окислительная способность перманганат-ионов в сильнощелочной среде усиливается?
Перманганатометрическое титрование нитритов можно проводить реверсивным титрованием: точный объём подкисленного серной кислотой стандартного раствора KMnO4 титруют исследуемым раствором нитрита до обесцвечивания. Почему прямое титрование, при котором подкисленный раствор нитрита титруют стандартным раствором KMnO4 в данном случае невозможно. Какой ещё способ титрования можно применить для перманганатометрического определения нитритов?
При перманганатометрическом определении Fe 2+ для более чёткого обнаружения конечной точки титрования к титруемому раствору рекомендуется добавить несколько мл концентрированной фосфорной кислоты. Объясните, почему в присутствии H3PO4 конечная точка перманганатометрического титрования Fe 2+ обнаруживается более чётко.
Для определения катионов Fe 2+ можно применять различные методы окислительно-восстановительного титрования. Какой из титриметрический методов: перманганатометрия или цериметрия лучше подходит для определения железа в растворе, содержащем большие количества хлорид-ионов?
Что такое «химическое потребление кислорода»? Объясните принцип определения данного показателя методом дихроматометрического титрования.
Объясните, почему значения формального потенциала окислительно-восстановительной пары Ce 4+ /Ce 3+ в 1 М HClO4, HNO3, H2SO4 и HCl отличаются (соответственно, +1,70; + 1,61; + 1,44 и +1,28В). Почему в 1 М HClO4 величина формального потенциала оказывается самой большой? Почему цериметрическое титрование обычно проводят в присутствии H2SO4, а не HClO4, HNO3 или HCl?
1. В качестве титранта в броматометрическом титровании используют:
2. В качестве стандартного вещества для стандартизации раствора KBrO3 применяют:
1) сульфаниловую кислоту; 2) стандартный раствор Na2S2O3;
3) KI; 4) стандартный раствор HCl; 5) K2Cr2O7.
3. В конечной точке броматометрического титрования окраска метилового оранжевого:
изменяется от жёлтой к оранжевой;
изменяется от оранжевой к малиновой;
изменяется от оранжевой к жёлтой;
вначале исчезает, а затем при добавлении избытка титранта вновь становится красной.
4. Дихроматометрическое титрование:
всегда проводят в сильнощелочной среде;
проводят в 3-9 М HCl;
используется для определения Fe 2+ ;
проводится в присутствии H2SO4;
не может быть использовано для определения этанола.
нельзя приготовить по точной навеске;
устойчив при хранении;
неустойчив при хранении и в запас не готовится;
нельзя подвергать нагреванию, так как растворённое вещество при этом выпадает в осадок.
6. Что из перечисленного ниже верно?
перманганатометрическое титрование проводят только в нейтральной среде;
после приготовления раствор KMnO4 оставляют на некоторое время, затем фильтруют и стандартизируют;
стандартизацию раствора KMnO4 проводят сразу же после приготовления;
в качестве индикатора при перманганатометрическом определении пероксида водорода используют крахмал;
растворы KMnO4 фильтруют через стеклянные, но не через бумажные фильтры.
7. Стандартизацию раствора перманганата калия с помощью оксалата натрия проводят:
1) при охлаждении до 5 С; 2) при нагревании до 70 С;
4) в щелочной среде;
8. Фактор эквивалентности глицерина в реакции окисления его перманганатом калия в сильнощелочной среде равен:
1) 1; 2) 1/20; 3) 1/14; 4) 5/14; 5) 14
5) HgI2 или CHCl3 для предотвращения развития микроорганизмов.
10. Соединения осмия используются при цериметрическом титровании в качестве:
1) катализатора; 2) индикатора; 3) титранта;
4) одного из компонентов буферного раствора;
5) комплексообразующего реагента, предотвращающего выпадение гидроксидов металлов
Навеску массой 0,1700 г порошка растёртых таблеток фенолфталеина (М = 318,33 г/моль), используемого в качестве слабительного средства, растворили в 15 мл 0,1 М NaOH. К раствору прибавили 25,0 мл 0,1 М 1/6 KBrO3, 5 мл раствора KBr (100 г/л) и после перемешивания 25 мл смеси уксусной и хлороводородной кислот. После взбалтывания к полученной смеси добавили 1 г KI и оттитровали выделившийся иод 0,1000 М Na2S2O3. Для титрования было израсходовано 6,50 мл раствора тиосульфата натрия (в контрольном опыте 24,90 мл). Рассчитайте среднюю массу фенолфталеина в 1 таблетке, если средняя масса 1 таблетки равна 0,2335 г.
Броматометрическое определение фенолфталеина основано на реакции бромирования данного вещества с образованием тетрабромфенолфталеина
KBrO3 + 5KBr + 6HCl 3Br2 + 6KCl + 3H2O
Избыток Br2, не вступивший в реакцию с определяемым веществом, провзаимодействовал с KI. Выделившийся иод был оттитрован стандартным раствором Na2S2O3:
Поскольку молекула фенолфталеина при бромировании провзаимодействовала с 4 молекулами брома (8 эквивалентами), то фактор эквивалентности для данного вещества равен 1/8.
Масса фенолфталеина в расчёте на среднюю массу 1 таблетки равна

Пробу раствора бромата калия объёмом 25,00 мл поместили в колбу с притёртой пробкой, добавили необходимые количества воды. HCl и KBr. Через 5 минут выделившийся иод оттитровали 0,1033 М Na2S2O3. Рассчитайте молярную концентрацию 1/6 KBrO3 в стандартизируемом растворе, если для титрования было израсходовано 24,70 мл раствора тиосульфата натрия. Ответ: 0,1021 моль/л.
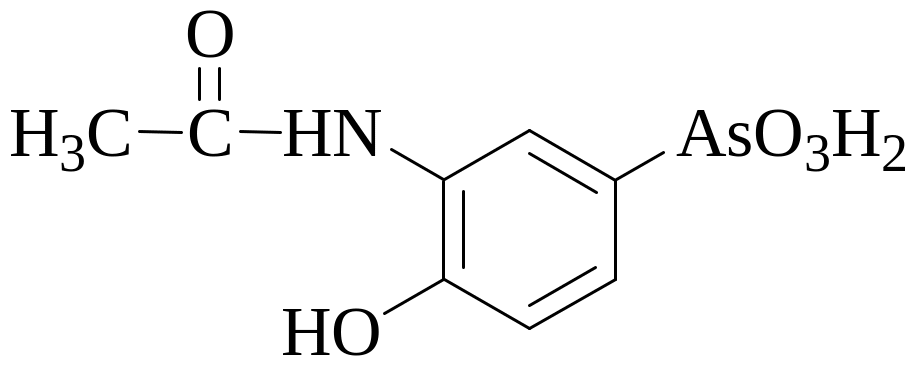
Навеску образца лекарственного вещества осарсола (М = 275,09 г/моль) массой 0,2200 г подвергли минерализации с помощью концентрированной азотной и серной кислот. Органическая часть молекулы при этом разрушилась, а мышьяк окислился до As(V). К минерализату добавили сульфат гидразина и нагревали полученный раствор в течение 30 минут, H3AsO4 при этом восстановилась до H3AsO3. Затем раствор охладили, добавили к нему 50 мл воды, 0,5 г бромида калия и необходимое количество индикатора метилового оранжевого. Для титрования полученного раствора было израсходовано 14,50 мл 0,1000 М 1/6 KBrO3 (в контрольном опыте 0,10 мл). Рассчитайте массовую долю осарсола в образце. Ответ: 90,03%.
Хлороформ, используемый в медицине, содержит в качестве стабилизатора 0,6 — 1,0% (по массе) этанола. Для определения содержания этанола в колбу с притёртой пробкой поместили 25,00 мл 0,1100 М 1/6K2Cr2O7, 25 мл концентрированной азотной кислоты. К охлаждённой смеси добавили 1,00 мл анализируемого образца хлороформа и оставили на 5 минут. Затем в колбу добавили 100 мл воды, 5 мл раствора KI (100 г/л) и через 5 минут оттитровали выделившийся иод 0,1000 М Na2S2O3. Рассчитайте массовую долю этанола в анализируемом образце, если для титрования потребовалось 15,00 мл раствора тиосульфата натрия. Плотность анализируемого образца хлороформа равна 1,48 г/мл. Ответ: 0,97%
Пробу раствора пероксида водорода объёмом 1,00 мл разбавили водой до 10,0 мл. К 1,00 мл полученного раствора прибавили 2 мл 16%-ного раствора серной кислоты и провели титрование 0,1000 М 1/5 KMnO4. Рассчитайте массовую концентрацию пероксида водорода в растворе (г/л), если для титрования было использовано 14,70 мл титранта. Ответ: 250 г/л.
Викасол (тригидрат, М = 330,29 г/моль) является синтетическим водорастворимым аналогом витамина К. Навеску образца викасола массой 0,3000 г растворили в 20 мл воды, добавили 5 мл 1 М NaOH и провели трёхкратную экстракцию продукта гидролиза викасола хлороформом. Хлороформный экстракт упарили досуха. Сухой остаток растворили в 15 мл CH3COOH, добавили 3 г цинковой пыли и оставили на 30 минут в тёмном месте.
Затем содержимое колбы профильтровали в другую колбу. Фильтрат оттитровали 0,1000 М Ce(SO4)2 в присутствии индикатора фенантролина. Рассчитайте массовую долю викасола в препарате, если для титрования фильтрата было затрачено 17,60 мл раствора Ce(SO4)2 (в контрольном опыте 0,30 мл). Ответ: 95,23%.
Навеску образца аминокислоты метионина (М = 149,21 г/моль) массой 0,2220 г растворили в 10% растворе NaOH, получив 100,0 мл раствора. К 10,00 мл этого раствора прибавили 10,00 мл 0,1000 М 1/6 KBrO3, 0,4 г KBr, хлороводородную кислоту и воду. Колбу, содержащую данную смесь, плотно закрыли и оставили на несколько минут в тёмном месте. После этого к содержимому колбы добавили 10 мл 10% раствора KI. Для титрования выделившегося иода потребовалось 4,20 мл 0,1020 М Na2S2O3. Рассчитайте массовую долю метионина в образце. Метионин при взаимодействии с бромом окисляется до соответствующего сульфона:
Навеску образца тимола (М = 150,22 г/моль) массой 0,4985 г растворили в растворе NaOH, получив 100,0 мл раствора. К 10,00 мл этого раствора прибавили 0,5 г KBr и 40 мл 8,3%-ного раствора HCl. Для титрования полученной смеси в присутствии метилового оранжевого потребовалось 13,15 мл 0,1005 М 1/6 KBrO3. Рассчитайте массовую долю тимола в анализируемом образце.
Навеску образца дигидрата хинина гидрохлорида (М = 396,22 г/моль) массой 0,2000 г растворили в 20 мл воды. К полученному раствору прибавили 20 мл концентрированного раствора HCl и 1 г KBr. Для титрования полученной смеси до появления устойчивой жёлтой окраски раствора потребовалось 10,00 мл 0,1000 М 1/6 KBrO3. Рассчитайте массовую долю дигидрата хинина гидрохлорида в анализируемом образце.
Пробу сточной воды объёмом 100,0 мл поместили в колбу и прибавили к ней 1 г HgSO4, 5 мл концентрированной H2SO4, 25,0 мл 0,25 М 1/6K2Cr2O7 и 0,4 г Ag2SO4. Содержимое колбы кипятили с обратным холодильником в течение 2-х часов, а затем количественно перенесли в другую колбу, добавили 100 мл дистиллированной воды и оттитровали избыток K2Cr2O7 0,2500 М FeSO4 в присутствии ферроина. Определелите ХПК данной сточной воды, если для титрования было израсходовано 6,50 мл стандартного раствора FeSO4 (в контрольном опыте — 25,50 мл).
Навеску массой 0,2122 г метиленового синего (М = 319,8 г/моль) — антидота, используемого при отравлении метгемоглобинообразующими веществами, растворили в горячей воде. К полученному раствору прибавили 25,00 мл 0,1000 М 1/6 K2Cr2O7 и нагревали в течение 5 минут. Выпавший осадок дихромата метиленового синего отфильтровали. Фильтр и стакан, в котором проводилась реакция, промыли несколько раз холодной водой. Затем к фильтрату с промывными водами прибавили 150 мл воды, 30 мл 16%-ного раствора H2SO4, 2 г KI и через 5 минут отфильтровали выделившийся иод стандартным раствором Na2S2O3. Рассчитайте массовую долю метиленового синего в анализируемом образце, если для титрования было израсходовано 5,10 мл 0,1008 М Na2S2O3.
Навеску образца лекарственного вещества «железо восстановленное» массой 0,9990 г растворили при нагревании в 25 мл разбавленной серной кислоты. После охлаждения раствор количественно перенесли в мерную колбу вместимостью 100,0 мл и довели свежепрокипячённой водой до метки. К 20,00 мл полученного раствора прибавили 10 мл разбавленной серной кислоты и оттитровали его стандартным раствором KMnO4, имеющим титр по дигидрату щавелевой кислоты 6,25010 -3 г/мл. Рассчитайте массовую долю железа в анализируемом образце, если для титрования было израсходовано 35,00 мл раствора перманганата калия.
Пробу водного раствора H2O2 объёмом 5,00 мл разбавили водой до 100,0 мл. Для титрования 10,00 мл полученного раствора в присутствии H2SO4 потребовалось 24,50 мл раствора перманганата калия, титр которого по дигидрату щавелевой кислоты равен 6,20010 -3 г/мл. Какой объём исследуемого раствора пероксида водорода следует разбавить водой до 100,0 мл, чтобы концентрация H2O2 в нём стала равной 10,0 г/л?
Пробу объёмом 20,00 мл водного раствора глицерина (М = 92,10 г/моль) прибавили к 25,00 мл щелочного 0,02000 М KMnO4. После окончания реакции смесь подкислили серной кислотой и добавили к ней 25,00 мл 0,1000 М 1/2H2C2O4. Для титрования избытка щавелевой кислоты потребовалось 10,20 мл 0,1100 М 1/5KMnO4. Рассчитайте массу глицерина, содержащегося в пробе. При взаимодействии с KMnO4 в щелочной среде глицерин окисляется до карбонат-иона и воды.
К 25,00 мл раствора Сe(SO4)2 прибавили 20 мл 16%-ного раствора H2SO4, 20 мл воды и 10 мл 10%-ного раствора KI. Для титрования выделившегося иода было израсходовано 24,80 мл 0,1011 М Na2S2O3. Рассчитайте: а) молярную концентрацию Ce(SO4)2 в стандартизируемом растворе и титр данного раствора; б) массу пероксида водорода, способного провзаимодействовать с 20,00 мл этого раствора.
Навеску массой 0,1190 г препарата токоферола ацетата /витамина Е/ (М = 472,8 г/моль) растворили в 10 мл C2H5OH. К полученному раствору добавили 10 мл этанольного раствора серной кислоты и кипятили с обратным холодильником в течение 2-х часов. После охлаждения реакционную смесь количественно перенесли в мерную колбу вместимостью 50,00 мл и довели до метки этанолом. К 20,00 мл полученного раствора прибавили 20 мл C2H5OH, 10 мл H2O и провели титрование 0,01000 М Ce(SO4)2 в присутствии индикатора дифениламина. Рассчитайте массовую долю токоферола ацетата в препарате, если для титрования было израсходовано 16,50 мл титранта (в контрольном опыте — 0,20 мл).
СТАНДАРТИЗАЦИЯ РАСТВОРА ПЕРМАНГАНАТА КАЛИЯ. ПЕРМАНГАНАТОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ПЕРОКСИДА ВОДОРОДА
Источник