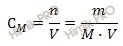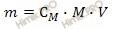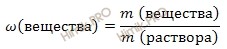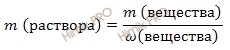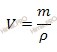Химик.ПРО – решение задач по химии бесплатно
Какой объем раствора азотной кислоты (HNO3) концентрированного с массовой долей равной 60 % и плотностью раствора 1,37 г/см 3 необходимо взять для приготовления 800 см 3 раствора с молярной концентрацией вещества, равной 2 моль/л?
Решение задачи
Найдем сколько концентрированной азотной кислоты (HNO3) (в граммах) потребуется для приготовления 800 см 3 (или 0,8 л объем раствора азотной кислоты) раствора с молярной концентрацией 2 моль/л. Для расчета будем использовать формулу нахождения молярной концентрации раствора:
CM – молярная концентрация раствора;
n – химическое количество растворенного вещества;
M – молярная масса растворенного вещества;
m – масса растворенного вещества;
V – объем раствора азотной кислоты.
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
Из вышеуказанной формулы выразим и рассчитаем массу растворенного вещества:
Учитывая, что молярная масса азотной кислоты (HNO3) равна 63 г/моль (смотри таблицу Менделеева), получаем:
m (HNO3 (конц.)) = 2 моль/л ∙ 63 г/моль ∙ 0,8 л = 100,8 (г).
Используя формулу нахождения массовой доли растворенного вещества:
выразим массу раствора азотной кислоты (HNO3):
m (раствора HNO3 (конц.)) = 100,8 г/ 0,6 = 168 (г).
Если раствор 60-процентный, то массовая доля азотной кислоты (HNO3) в нем 0,6.
Вычислим объем раствора азотной кислоты (HNO3) концентрированного, который потребуется для приготовления 0,8 л раствора с молярной концентрацией 2 моль/л. Будем использовать формулу, устанавливающую связь между объемом раствора азотной кислоты и массой раствора:
Получаем, объем раствора азотной кислоты:
V (раствора HNO3 (конц.)) = 168 г /1,37 г/мл = 122,63 (мл).
Ответ:
объем раствора азотной кислоты концентрированного 122,63 миллилитра.
Источник
Сколько граммов 60 раствора азотной кислоты надо взять чтобы приготовить 200 мл раствора
Задача 20
Расчитаете молярную и нормальную концентрации раствора, содержащего 222 г хлорида кальция в 2000 мл раствора.
Решение:
Молярная конц-я (к-во молей в литре р-ра):
Cм = n/V = m/(M ∙ V) = 222 / (111 ∙ 2) = 1M (или 1 моль/л)
Нормальная (эквивалентная) конц-я (число г-экв. в-ва в 1 л р-ра): Сн = m/(Mэ∙V)
Mэ соли = Мсоли / z соли
z — произведение числа катионов на его заряд (или произведение числа анионов на его заряд) = 111/2 = 55,5 г-экв./моль
Сн = m/(Mэ∙V) = 222 /(55,5 ∙ 2)= 2 Н
Можно было и просто пересчитать Cм в Cн по формуле: Cн = Cм ∙ z
Задача 21
Сколько граммов карбоната натрия надо взять, чтобы приготовить 500 мл 0,25 н раствора?
Решение:
m(Na2СO3) = Cн ∙ V ∙ Мэ(Na2СO3) = Cн ∙ V ∙ Мr(Na2СO3)/z = 0,25 ∙ 0,5 ∙ 106/2 = . г
Задача 22
Масса (г) гидроксида натрия, содержащегося в 100 см3 раствора с концентрацией 0,5 моль/л, равна:
Решение:
m=n∙M
n= C∙V
m=C∙V∙M = 0,5 ∙ 0,1 ∙ 40 = 2 г
Задача 23
В 200 гр 20% раствора соляной кислоты добавили 100 г воды. Вычислить концентрацию полученного раствора.
Решение:
200 г 20% р-ра содержат 40 г кислоты:
m(кислоты) = m(р-ра) ∙ ω = 200 ∙ 0,2 = 40 г
После добавления воды масса раствора:
m2(р-ра) = m1(р-ра) + m(воды) = 200+100 = 300 г
Конц-я полученного р-ра:
ω2% = m(кислоты) ∙ 100 / m2(р-ра) = 40 ∙ 100 / 300 =
13,3%
Можно и иначе:
при добавлении воды (т.е. при разбавлении раствора) масса растворенного вещества не меняется, а меняется только масса раствора и концентрация ⇒
m1(р-ра) ∙ ω1 = m2(р-ра) ∙ ω2
отсюда: ω2 = m1(р-ра) ∙ ω1 / m2(р-ра) =
200 г ∙20% / 300 г = 13,3%
Задача 24
Сколько граммов воды нужно добавить к 50 г 10% раствора медного купороса, чтобы он стал 5%?
Решение:
Точно так же можно двумя способами решить и эту задачу:
m1(р-ра) ∙ ω1 = m2(р-ра) ∙ ω2
m2(р-ра) = m1(р-ра) ∙ ω1 / ω2 = 50 ∙ 10 / 5 = 100 г
m(воды) = m2(р-ра) — m1(р-ра) = 100 — 50 = 50 г
Или иначе:
50 г 10% р-ра содержат 5 г купороса:
m(купороса) = m(р-ра) ∙ ω = 50 ∙ 0,1 = 5 г
После добавления воды масса раствора:
m2(р-ра) = m(купороса)/ω2 = 5/0,05 = 100 г
m(воды) = m2(р-ра) — m1(р-ра) = 100 — 50 = 50 г
Задача 25
Для определения железа (III) в исследуемом растворе методом сравнения были получены следующие значения оптической плотности: 0,216 — для исследуемого раствора; 0,148 — для стандартного раствора с концентрацией 1,20 мкг/мл. Чему равна концентрация железа (III) в исследуемом растворе?
Решение:
Ах/Аст = Сх/Сст, отсюда Сх = Сст∙Ах/Аст = 1,20 мкг/мл ∙ 0,216 / 0,148 = 1,75 мкг/мл
Задача 26
Вычислите массу азотной кислоты, которая содержится в 200 мл 0,1 м раствора.
Решение:
m=n x M
M=63 г/моль
n=CV = 0,2 x 0,1 = 0,02 моль
m = 63 г/моль x 0,02 моль = 1,26 г
Задача 27
В 600 граммов 10% раствора добавили 5 граммов соли. Чему равна массовая доля растворенного вещества в полученном растворе?
Решение:
В 600 г р-ра были 600 ∙ 0,1 = 60 г соли.
Добавили 5 г соли:
масса соли: m (соли) = 60+5= 65 г
масса раствора: m (раствора)= 600+5=605 г
w = m (соли) / m (раствора) = 65/605=0,107 (10,7%)
Задача 28
Вычислить нормальность раствора NaOH, титр которого равен 0,004020.
Решение:
Нормальность Сн =z ∙ n/V (z- число эквивалентности)
Титр раствора Т=m/V — масса растворённого вещества в 1 мл (0,001 л) раствора. =>
Сн = z ∙ Т ∙ 1000 /М
Для однокислотного основания NaOH z=1
M (NaOH) = 40 г/моль
Сн =0,004020 ∙ 1000 / 40 = 0,1005 н
Задача 29
Сколько миллилитров 4 н HCl надо прибавить к 500 мл раствора HCl с титром по CaO 0,08400, чтобы получить раствор с титром по CaО равным 0,09000?
Решение:
T1 (HCl/CaO) = 0,08400 г/мл
V1= 500 мл = 0,5 л
T3 (HCl/CaO) = 0,09000 г/мл
V3=V1+ V2
С2= 4 н
V2 = х л
n3 = n1 + n2
n = CV
С = z ∙ Т ∙ 1000 /М
2HCl + CaO → CaCl2 + H2O
На 1 моль CaO приходится 2 моль HCl → число эквивалентности z=2.
C1 = 2 ∙ T1(HCl/CaO) ∙ 1000/ M(CaO) = 2000 ∙ 0,08400 / 56,0774 = 2,99586 (моль/л)
C3 = 2 ∙ T3(HCl/CaO) ∙ 1000 / M(CaO) = 2000 ∙ 0,09000 / 56,0774 = 3,20985 (моль/л)
V1= 0,5 л
V2 = х
V3 = V1+ V2 = y
C3V3 = C1V1 + C2V2
Составляем систему уравнений:
y = 0,5 + х
3,20985y = 2,99586 ∙ 0,5 + 4 ∙ x
3,20985 ∙ (0,5 + x) = 1,49793 + 4x
1,60493 + 3,20985x = 1,49793 + 4x
0,79015x = 0,10700
x = 0,13542 л= 135,42 мл
Задача 30
Какой объём воды нужно прибавить к 50 мл 24%-ного раствора аммиака плотностью 0,91 г/мл, чтобы приготовить 6%-ный раствор плотностью 0,97 г/мл?
Решение:
V1∙ρ1∙ω%1 = V2∙ρ2∙ω%2
V2 = V1∙ρ1∙ω%1 / (ρ2∙ω%2) = 50∙0,91∙24/ (0,97∙6) = 187,6 мл
V воды = 187,6 — 50 = 137,6 мл
Задача 31
Определите молярную концентрацию и молярную концентрацию эквивалента раствора калия дихромата, если навеску массой 0,4832г растворили и довели водой до метки в мерной колбе вместимостью 1л. Чему равен титр полученного раствора?
Решение:
М(K2Cr2O7) = 294 г/моль
Cм = n / V = m/(M∙V) = 0,4832/(294∙1) = 1,64 ∙ 10^-3 М
Сн =z ∙ Cм (z- число эквивалентности) = 2 ∙ 1,64 ∙ 10^-3 = 3,28 ∙ 10^-3 н
(z = заряд катиона ∙ к-во молей катионов в 1 моль соли = заряд аниона ∙ к-во молей анионов в 1 моль соли)
Титр раствора Т=m/V — масса растворённого вещества в 1 мл раствора:
Т= 0,4832 / 1000 = 0,4832 ∙ 10^-3 г/мл
Задача 32
Сколько мл 10,0 %-го раствора карбоната натрия (p=1,105 г/см3) потребуется для приготовления 1,5 л раствора с Т=0, 0590 г/см?
Решение:
Т=0,0590 г/см, поэтому 1,5 л р-ра содержат:
m = Т ∙ V ∙ 1000 = 0,0590 ∙ 1,5 ∙ 1000 = 88,5 г Na2CO3
m (раствора) = m (Na2CO3) / ω = 88,5 / 0,1 = 885 г
V(раствора) = m (раствора) / ρ = 885 / 1,105 = 801 см3 = 0,801 л
Задача 33
Какова молярная концентрация 50% раствора азотной кислоты (р=1,31г/мл)?
Решение:
Переход от массовой доли к молярности:
См = 1000ρ ∙ ω / М = 1000 мл/л ∙ 1,31 г/мл ∙ 0,5 / 63,0 г/моль= 10,4 моль/л
Пояснение к формуле:
См = n(в-ва) / V(р-ра, л)
n=m(в-ва)/M(в-ва)
m(в-ва)=m(р-ра) ∙ ω
V (мл)=m(р-ра)/ρ(р-ра г/мл) = m(р-ра)/1000ρ(р-ра г/л)
=> См = m(р-ра) ∙ ω / M(в-ва) ÷ m(р-ра) / 1000ρ(р-ра) =
1000ρ(р-ра) ∙ ω / M(в-ва)
Решение:
Масса соли в получ. растворе:
m (соли) =m1 + m2 = m(p-pa1) ∙ ω1 + m2 = 280 ∙ 0,15 + 12 = 54 г
Решение:
ω%=m(глицина) x 100 / m(раствора) = 0,2 х 100 / 30,2 = . %
Задача 36
Чему равна процентная концентрация растворенного вещества в растворе, если из 1800 г 5%-ного раствора выпарить 800 г воды?
Решение:
ω%1 ∙ m1 (p-pa) = ω%2 ∙ m2 (p-pa)
ω%2 = 1800 ∙ 5 / 1000 =9%
Задача 37
Выразите состав раствора вещества HClO4 с заданной массовой долей = 16% и плотностью р = 1,100 г/см3 через молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию и титр.
Решение:
В 100 г р-ра 16 г HClO4 и 84 г воды.
Молярная конц-я См = n(HClO4) / V (р-ра)
V= m (р-ра) ∙ ρ (р-ра) = 100 ∙ 1,1 = 110 мл = 0,11 л
n=m(HClO4) / M (HClO4)
См = m(HClO4) / [ M (HClO4) ∙ V (р-ра) ] = 16 / (100,5 ∙ 0,11) = 1,45 моль/л (или 1,45 М)
Молярная конц-я экв. Сн = См ∙ z
Кислота одноосновная, z=1, Сн = См = 1,45 моль-экв./л (или 1,45 н)
В 1000 г (1 кг) р-ра 160 г HClO4, что составляет:
n=m / M = 160 / 100,5 = 1,59 моль, след,
моляльная конц-я Сm = n(HClO4) / m (р-ра) = 1,59 моль/кг
Титр раствора Т=m/V — масса растворённого вещества в 1 мл раствора
В 110 мл р-ра 16 г HClO4
Т= 16/110 = 0,145 г/мл
Задача 38
Определите искомую величину массовой доли KNO3 и массу воды m(Н20), необходимые для приготовления раствора KNO3 массой 560 г, где m(KNO3) = 28г. Рассчитайте моляльную концентрацию и молярную долю вещества KNO3 в полученом растворе.
Решение:
m(KNO3) = 28 г
m(раствора) = 560 г = 0,56 кг
m(Н20) = m(раствора) — m(KNO3) = 560 — 28 = 532 г
Массовая доля:
ω(KNO3) = m(KNO3) / m(раствора) = 28 / 560 = 0,05 (∙ 100 = 5%)
Моляльная конц-я:
Сm = n(KNO3) / m(раствора, кг)
n(KNO3) = m(KNO3) / M(KNO3)
Сm = m(KNO3) / [M(KNO3) ∙ m(раствора, кг)] = 28/(101∙ 0,56) = 0,495 моль/кг
Мольная (молярная) доля — отношение числа молей растворенного вещества к общему числу молей всех веществ, имеющихся в растворе:
Х(KNO3) = n(KNO3) / [n(KNO3) + n(Н20)]
n(Н20) = m(Н20) / М(Н20)
χ(KNO3) = (28/101) / (28/101 + 532/18) = 0,0093
Задача 39
Вычислить нормальность и титр след. растворов: а)HCl пл. 1.108 г/см3 б) H2SO4 пл. 1.814 г/см3
е) NH4OH пл. 0.904 г/см3.
Решение:
Если известна плотность раствора, то процентную концентрацию его можно найти в справочных таблицах, а по плотности и процентной концентрации можно рассчитать нормальность раствора и титр.
http://fptl.ru/spravo4nik/plotnost-1.html
а) HCl, ρ = 1.108 г/см3 => ω(HCl) = 0,22
Пусть V = 1 л = 1000 см3
m (раствора) = V ∙ ρ = 1.108 ∙ 1000 = 1108 г
m (HCl) = m (раствора) ∙ ω = 1108 ∙ 0,22 = 245 г
n = m/M = 245 / 36,5 = 6,7 моль
Сн = n экв. / V
n экв. = n ∙ z
Для одноосновной к-ты z = 1 => nэкв. = n
Сн = n экв. / V = 6,7 / 1 = 6,7 н
Титр раствора Т=m/V — масса растворённого вещества в 1 мл раствора
T = 245/1000 = 0,245 г/мл
Источник
Сколько граммов 60 раствора азотной кислоты надо взять чтобы приготовить 200 мл раствора
Кристина,
Задача 232
Сколько миллилитров раствора фосфорной кислоты, мольная доля которого 0,01 (плотность раствора 1,025 г/см³), надо взять, чтобы получить 200 г раствора концентрацией 2,6%?
Решение:
200 г раствора концентрацией 2,6% содержат:
m(H3PO4) = m(p-pa)∙ω%/100 = 200 ∙ 2,6 / 100 = 5,2 г
При разбавлении масса раствореного в-ва не меняется, поэтому исх. р-р содержит 5,2 г H3PO4, что составляет n(H3PO4)=m(H3PO4)/M(H3PO4) = 5,2 / 98 = 0,05306 моль
Мольная доля исх. р-ра:
χ=n(H3PO4)/(n(H3PO4)+n(H2O)) = 0,01
Обозначим n(H2O)=х, тогда:
0,05306 /(0,05306 + х) = 0,01
n(H2O) = х = (0,05306 — 0,05306∙0,01)/0,01 = 5,253 моль
m(Н2О) = n(H2O) ∙ М(H2O) = 5,253 ∙ 18 = 94,6 г
Объем исходного р-ра:
V(p-pa) = (m(Н2О) + m(H3PO4)) / ρ = (94,6 + 5,2)/1,025 = 97,4 мл
Ольга,
Задача 233
Вычислить массу воды, необходимую для приготовления раствора хлорида натрия, содержащего 1,50 моль NaCl на 100 г воды,если имеется 10 г NaCl.
Решение:
100 г воды содержат 1,50 моль NaCl
х г воды содержат n(NaCl) = m/M = 10 г / 58,44 г/моль NaCl
m(H2O) = х = 100 ∙ 10 / (58,44 ∙ 1,50) = 11,4 г
Юлия,
Задача 234
В каком объеме 0,5 н раствора содержится 5 г HNO3?
Решение:
V=n ∙ z / Cн
Фактор эквивалентности (z) кислоты равен ее основности ⇒ z(HNO3) =1
n=m / M
Отсюда:
V = m ∙ z / (Cн ∙ M) = 5 г / (0,5 моль/л ∙ 63 г/моль) = 0,1587 л = 158,7 мл
Решение:
Са(NO3)2
а) См=1,100 М
Нормальность Сн=См ∙ z
Фактор эквивалентности (z) соли равен произведению заряда катиона на число катионов (или то же для анионов) ⇒ z(Са(NO3)2) =2, Сн=1,100 ∙ 2 = 2,200 н
Титр Т = Cм ∙ M / 1000 = 1,100 ∙ 164,1 / 1000 = 0,1805 г/мл
Вывод формулы:
Т=m/V(мл) = m/1000V(л)
m = n∙M
n = Cм ∙ V(л)
⇒ Т = Cм ∙ M / 1000
Массовая доля ω = Cм ∙ M / 1000ρ = 1,100 ∙ 164,1 / 1128 = 0,1600, или 16,00%
Вывод формулы:
ω = m(Са(NO3)2)/m(p-pa)
m(Са(NO3)2)=n ∙ M=Cм ∙ V(л) ∙ M
m(p-pa) = V(p-pa, мл) ∙ ρ = V(л) ∙ ρ ∙ 1000
⇒ ω = Cм ∙ V(л) ∙ M / (V(л) ∙ ρ ∙ 1000) = Cм ∙ M / 1000ρ
Моляльность Cm=n(в-ва)/m(воды, кг)
ω%=16%, т.е. 1 кг р-ра содержит 160 г Са(NO3)2) и 840 г = 0,840 кг воды
n(Са(NO3)2) = m(Са(NO3)2) / М(Са(NO3)2) = 160 / 164,1 = 0,9750 моль
Cm = 0,9750 / 0,840 =1,161 моль/кг
Мольная доля
χ = n(в-ва)/(n(в-ва) + n(воды))
n(воды) = 840 г / 18 г/моль = 46,67 моль
χ = 0,9750 / (0,9750 + 46,67) = 0,02047
Источник