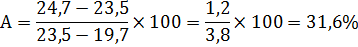Получение накопительной культуры азотфиксаторов
Для накопления свободноживущих азотфиксаторов используют среду Эшби, не содержащую минеральных и органических источников азота, следующего состава: (г/л): маннит — 20,0; К2НРО4 — 0,2; MgS04 — 02; NaCl — 0,2; K2SO4 — 0,1; СаСОз — 5,0; агар — 20,0; рН 7,1—7,3. Среду разливают в пробирки,стерилизуют при 0,5 ати и готовят скошенный агар. Посев проводят штрихом. Продолжительность культивирования — 7—10 суток. Инкубируют при температуре 28-30 о С. Через 5-7 суток на поверхности среды образуется жирная пленка, сначала серовато-белая, а затем постепенно буреющая. Микроскопируя пленку, можно обнаружить клетки азотфиксирующих бактерий. Необходимо отметить, что на среде Эшби могут расти не только микроорганизмы, фиксирующие молекулярный азот, но и олиго-нитрофилы, т. е. микроорганизмы, способные усваивать ничтожные количества связанного азота, содержащегося в реактивах, воде и воздухе. Обильный рост на среде Эшби может свидетельствовать о принадлежности бактерий к азотфиксаторам.
Среды для культивирования азотфиксирующих клубеньковых бактерий разработаны немецким ботаником Бейеринком в 1980 годы. Для культивирования клубеньковых бактерий он употребил отвар листьев и корней бобовых растений, содержащий 0,25% аспарагина, 0,5% глюкозы и 7% желатина. Этот новый принцип культивирования бактерий, основанный на стимуляции их развития ростовыми веществами, дал блестящие результаты.
Молекулярный азот могут фиксировать и анаэробные бактерии. Для выявления этой способности у представителей рода Clostridium используют среду следующего состава (г/л): дрожжевой экстракт — 0,015; глюкоза — 20,0; К2НРО4 — 11,0. MgS04 х 7Н20 — 0,5; NaCl, MTIS04 и FeS04 — следы (по 1 мл 1%-ного раствора каждой соли); СаСОз — 20,0; рН 7,0. Среду разливают в высокие пробирки и стерилизуют при 0,5 ати. После стерилизации пробирки доливают почти до пробки стерильной средой и прогревают на кипящей водяной бане в течение 20—30 мин для удаления растворенного в среде кислорода. Затем среду в пробирках быстро охлаждают под струей холодной воды и проводят посев суспензией микроорганизмов. Посевной материал вносят пипеткой на дно пробирки. Продолжительность культивирования — 2—7 суток. По окончании опыта отмечают рост азотфиксаторов (помутнение среды, образование газа, появление запаха масляной кислоты) или его отсутствие.
Дата добавления: 2014-12-27 ; просмотров: 1893 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Метод обрастания комочков почвы. Среда Эшби
Состав среды Эшби:
Среду Эшби готовят следующего состава (г\л водопроводной воды): маннит — 20,0; K2HPO4 — 0,2; MgSO4 x 7H2O — 0,2; NaCl — 0,2; K2SO4 — 0,1; CaCO3 — 5,0; агар — 20,0. Добавляют смесь микроэлементов по Фёдорову ─ 1 мл [6].
Для того чтобы исследовать небольшое количество микроорганизмов во многих случаях применяется метод обрастания комочков почвы. Этим методом обычно определяют количество бактерий рода Azotobacter в почве.
Изначально исследуемый серозем был увлажнен до кашеобразного состояния. Затем микробиологической иглой формировались комочки, которые располагались на среде Эшби примерно на расстоянии 0,5 см друг от друга. Таким образом, по всей площади чашки Петри были разложено 25 комочков. Для среды Эшби было произведено две повторности. Засеянные чашки Петри убрали в термостат с температурой 30 градусов.
Определение влажности почвы
Гигроскопическая влажность — это влага, сорбируемая из воздуха и удерживаемая на поверхности твердых частиц воздушного-сухого образца почвы. Величина гигроскопической влаги находится в тесной взаимосвязи от относительной влажности воздуха, с которым соприкасается почва. Чем выше насыщенность воздуха водяными парами, тем выше и гигроскопическая влажность почвы.Гигроскопическую влажность определяют методом высушивания образца почвы, предварительно взвешенного, в эксикаторе при 105 градусах до постоянной массы. После достижения постоянной массы бюкс с навеской почвы снова взвешивают и определяют содержание воздушно-сухой почвы на 1 г сырой. Показатели гигроскопической влажности используют для пересчета полученных результатов анализов на сухую почву.
Влажность (А) определяется по формуле:
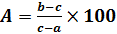
а— масса пустого бюкса,
b— масса бюкса с сырой почвой,
c— масса бюкса с сухой почвой.
Масса абсолютно сухой почвы в 1 г свежей, рассчитываем по формуле:m=1−(31,6/100) =0,68
Глава 4. Результаты исследований
Последнее изменение этой страницы: 2018-04-12; просмотров: 169.
Источник
Лабораторная работа № 14



Выделение почвенных микроорганизмов на элективных питательных средах.
Теоретические пояснения:
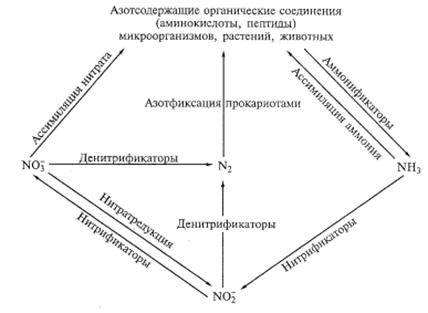
В природе цикл азота состоит из нескольких этапов, основную роль в которых играют микроорганизмы, преимущественно бактерии. При этом только бактерии могут выполнять все реакции цикла. В этом участвует молекулярный азот и его связанные соединения – минеральные и органические (Рис. 17). Процессом фиксации атмосферного азота лимитированы все остальные звенья превращения азота.
Рис.17. Глобальный цикл азота и микроорганизмы, участвующие в нем
(По Нетрусову, 2005)
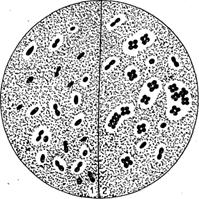
Уникальные по своей метаболической способности азотфиксирующие микроорганизмы имеют ферментный комплекс – нитрогеназу, активирующую инертную молекулу атмосферного азота. Процесс восстановления молекулы азота до аммиака требует затраты больших количеств энергии и идет через ряд промежуточных продуктов. Образование нитрогеназы связано с наличием в клетках азотфиксирующих микроорганизмов nif-плазмиды, которая содержит nif-ген, регулирующий синтез этого белка. Передача nif-плазмиды от одного вида бактерий к другому может привести к появлению азотфиксирующей способности у новых видов микроорганизмов. Кислород репрессирует синтез нитрогеназы. Ее активность проявляется при низкой концентрации кислорода в газовой среде. Даже аэробные азотфиксаторы осуществляют процесс фиксации азота в микроаэробных условиях, для создания которых у них имеются различные защитные приспособления. Так, свободноживущий аэробный азотфиксатор Azotobacter образует слизь, препятствующую диффузии кислорода в клетки и тем самым созданию вокруг них микроаэробной зоны (Рис. 18).
Рис. 18. Azotobacter: 1 — одиночные и двойные клетки с капсулами; 2 — сардинная форма с капсулой. Агар Эшби, тушь, фуксин
К тому же азотобактер часто находится в ассоциации с неазотфиксирующими аэробами, защищающими нитрогеназу азотобактера от доступа кислорода. Способность микроорганизмов фиксировать азот атмосферы и обогащать им почву нашла применение в сельском хозяйстве. На основе использования таких микроорганизмов, как клубеньковые бактерии и азотобактер, получают бактериальные удобрительные препараты нитрагин и азотобактерин. Биологическая фиксация азота в природе осуществляется свободноживущими и симбиотическими бактериями. Микроорганизмами, способными к симбиотической фиксации азота, являются бактерии рода Rhizobium.
К наиболее важным микроорганизмам, осуществляющим не симбиотическую фиксацию азота, относятся цианобактерии (Anabaena и Nostoc), Azotobacter, Beijerinckia, Bacillus polymyxa, Clostridium и др.
Денитрификация – это процесс восстановления нитратов до нитритов и далее до какой либо из газообразных форм азота (окиси азота, закиси азота, молекулярного азота).
Способность к денитрификации обнаружена у многих почвенных и водных прокариот, среди них есть фото- и хемотрофы. Наиболее часто она встречается у грамположительных бактерий рода Bacillus, Micrococcus, грамотрицательных Pseudomonas (Рис.19).
Рис. 19. Денитрифицирующие бактерии. Среда Гильтая
Факультативные анаэробы, переключаются на денитрификацию в отсутствии кислорода. В присутствии кислорода характерно кислородное дыхание. В анаэробных условиях используют нитраты и нитриты как конечные акцепторы электронов при окислении органических субстратов для получения энергии. Серная бактерия Thiobacillus denitrificans восстанавливает нитраты в процесс окисления серосодержащих соединений. Выход энергии при денитрификации только на 10 % ниже, чем при кислородном дыхании. Денитрификация – одна из причин обеднения почв азотом и неполного использования растениями вносимых в почву азотных удобрений. Процесс имеет большое экологическое значение, так как восстанавливает баланс азота в атмосфере, являясь единственным источником азота в атмосфере.
Цель работы: выделить из почвы культуру аэробных азотфиксаторов и денитрификаторов и промикроскопировать.
Материалы и оборудование: питательная среда Эшби, колбы, пробирки, образцы почвы, стеклянные палочки, спиртовки, реактивы: 10% р-р хлорнокислого железа, чашки Петри.
Ход работы:
Культивирование аэробных азотфиксаторов

1. Приготовить питательную среду Эшби.
Состав питательной среды (в г на 1л дистиллированной воды): маннит, или глюкоза, или сахароза – 20,0, К2НР04 — 0,2, MgSO4 — 0,2, NaCl — 0,2, K2SO4 — 0,2, СаСО3 — 5,0.
2. Среду разлить в колбы объемом 100-150 мл слоем 1–1,5 см, заразить почвой ( 1 /2 чайной ложки) и поставить в термостат при температуре 28 °С.
3. Через 5–7 суток на поверхности среды образуется жирная пленка, сначала серовато-белая, а затем постепенно буреющая. Промикроскопировать клетки азотфиксирующих бактерий, подготовив прижизненный препарат из пленки.
4. Выявить капсулу методом негативного контрастирования. Для этого
каплю исследуемой культуры поместить в каплю разбавленного фуксина, а затем смешать с каплей туши и закрыть покровным стеклом. Тушь заполняет пространство, окружающее клетки, в результате чего хорошо видны не окрашивающиеся капсулы.
5. Сделать зарисовки.
1. Приготовить питательную среду Гильтая. Раствор I: KNO3 – 2 г, аспарагин – 1 г, дистиллированная вода – 250 мл, раствор II: КН2РО4 — 2,0 г, МgSО4 — 2,0 г, СаСl2 — 0,2 г, FеСl3 — следы, лимоннокислый натрий — 5,0 г, дистиллированная вода – 500 мл. Растворы I и II слить, довести объем среды до 1000 мл дистиллированной водой.
2. По индикатору бромтимоловому синему установить pH 6,8- 7,2.
Среду разлить высоким слоем в большие пробирки и стерилизовать в автоклаве при 1 атм 20 мин.
3. Пробирки со средой заразить комочком почвы, закрыть плотно пробками и поместить в термостат при температуре 30–35°С. Для создания анаэробных условий поверхность жидкости в пробирках покрыть тонким слоем стерильного нейтрального масла.
4. Через 7–10 суток проанализировать среду. Отметить помутнение жидкости в пробирках, выделение газов (CO2 и N2). Нередко на среде с лимонной кислотой наблюдается позеленение жидкости в пробирке, что указывает на развитие бактерий Pseudomonas pyocyanea. Содержимое пробирки проверить на исчезновение нитратов и нитритов по качественной реакции с дифениламином и реактивом цинк-иод-крахмал и на появление аммиака в среде реактивом Несслера. Обычно после 6–7 суток инкубации пробы на нитраты и нитриты дают отрицательную реакцию, а проба на аммиак бывает положительной, что свидетельствует о восстановлении нитратов до аммиака.
5. Из жидкости, находящейся в пробирке, приготовить микропрепарат. В поле зрения микроскопа видна масса мелких палочковидных клеток, неспорообразующих, располагающихся одиночно, скоплениями либо в виде коротких цепочек.
6. Сделать зарисовки.
Вопросы для самоконтроля:
1. Что называется денитрификацией?
2. Какова роль ферментного комплекса нитрогеназы?
3. Какое значение имеют процессы денитрификации и азотфиксации в биосфере?
Источник
Агар Ашби (с глюкозой или маннитом)
Агар Ашби с глюкозой или маннитом
Среды Ашби применяют для выращивания видов Azotobacter, которые могут использовать глюкозу или маннит и атмосферный азот в качестве источников углерода и азота, соответственно.
Состав**:
Конечное значение рН (при 25ºС) 7,4 ± 0,2
** Состав выверен и доведен до соответствия необходимым параметрам
Приготовление:
Размешать 40,7 г порошка в 1000 мл дистиллированной воды. Подогреть до кипения для полного растворения частиц. Стерилизовать автоклавированием при 1,1 атм (121ºС) в течение 15 мин.
Принцип и оценка результата:
Состав сред Ашби дан по описанию Subba Rao (1). Их применяют для выделения видов Azotobacter, несимбионтных азотфиксирующих бактерий, которые могут использовать глюкозу или маннит и атмосферный азот в качестве источников углерода и азота, соответственно. Помимо способности фиксировать атмосферный азот, азотобактеры также синтезируют биологически-активные вещества, способные улучшать прорастание семян, рост растений и проч.
Контроль качества:
Внешний вид порошка:
Гомогенный сыпучий белый порошок.
Плотность готовой среды:
Образуется среда, соответствующая по плотности 1,5%-ному агаровому гелю.
Цвет и прозрачность готовой среды:
Готовая среда имеет беловатую окраску, опалесцирует, когда в чашках Петри формируется гель.
Кислотность среды:
При 25ºС водный раствор (4,07% вес/об) имеет рН 7,4 ± 0,2.
Культуральные свойства:
Ростовые характеристики референс-штаммов через 5 дней при 37ºС на среде М713.
Ростовые характеристики референс-штаммов через 5 дней при 37ºС на среде М706.
Условия и сроки хранения:
Порошок хранить при температуре ниже +25ºС. Использовать до даты, указанной на этикетке. Готовую среду хранить при температуре +2…8ºС.
Источник