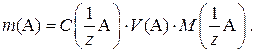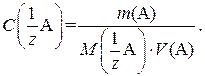Приготовление и стандартизация раствора соляной кислоты
Соляная кислота не относится к тем веществам, из которых можно приготовить раствор точно концентрации по навеске. Поэтому сначала готовится раствор кислоты приблизительной концентрации, а точная концентрация устанавливается путем титрования по Na2CO3или по Na2B4O7.10H2O.
1. Приготовление раствора соляной кислоты
По формуле С(HCl) =
рассчитывается масса хлороводорода, необходимая для приготовления 1 л раствора кислоты с молярной концентрацией эквивалента 0,1 моль/л.
m(HCl) = C(HCl) . Mэ(HCl) .V(р-ра),
где Mэ(HCl) = 36,5 г/моль;
m(HCl) = 0,1. 36,5 . 1 = 3,65 г.
Поскольку раствор соляной кислоты готовится из концентрированной, необходимо с помощью ареометра измерить ее плотность и по справочнику найти, какому процентному содержанию соответствует кислота такой плотности. Например, плотность (r) = 1,19 г/мл, w = 37 %, тогда
m(р-ра) = 
V(р-ра) = m(р-ра)/r = 9,85/1,19 = 8 мл.
Таким образом, для приготовления 1 л раствора HCl, C(HCl) = 0,1 моль/л, отмеривают при помощи цилиндра (объемом 10 – 25 мл) или градуированной пробирки около 8 мл соляной кислоты (r = 1,19 г/мл), переносят ее в склянку с дистиллированной водой и доводят раствор до метки. Приготовленный таким образом раствор HCl имеет приблизительную концентрацию (» 0,1 моль/л).
2. Приготовление стандартного раствора карбоната натрия
Рассчитывается навеска карбоната натрия, необходимая для приготовления 100,0 мл раствора с молярной концентрацией эквивалента 0,1 моль/л.
Предварительно на технических весах взвешивают 0,5–0,6 г Na2CO3. Переносят навеску на часовое стекло, заранее взвешенное на аналитических весах, и точно взвешивают стекло с навеской. Навеску переносят через воронку в мерную колбу на 100 мл, добавляют приблизительно до 2/3 объема дистиллированной воды. Содержимое колбы перемешивают осторожными вращательными движениями до полного растворения навески, после чего доводят раствор до метки.
3. Стандартизация раствора соляной кислоты
Для установления точной концентрации соляной кислоты используется приготовленный раствор Na2CO3точной концентрации. Водный раствор карбоната натрия вследствие гидролиза имеет щелочную реакцию среды:
2NaOH + 2HCl = 2NaCl + 2H2O;
Из суммарного уравнения видно, что в результате реакции в растворе накапливается слабая угольная кислота, определяющая рН в точке эквивалентности:
рН = 1/2 рК1(Н2СО3)– 1/2 lgС(H2CO3)= 1/2 .6,35 – 1/2lg 0,1 = 3,675.
Для титрования лучше всего подходит метиловый оранжевый.
Бюретку ополаскивают приготовленным раствором HCl и наполняют ее почти доверху раствором соляной кислоты. Затем, подставив под бюретку стакан и приоткрыв зажим, заполняют нижний конец бюретки так, чтобы в ней не оставалось пузырьков воздуха, нижний мениск раствора HCl в бюретке должен находиться на нулевом делении. При отсчете по бюретке (и пипетке) глаз должен быть на уровне мениска.
Ход определения. В колбу для титрования пипеткой отбирают 10,00 мл приготовленного раствора Na2CO3, добавляют 1–2 капли метилового оранжевого и титруют раствором HCl до изменения цвета из желтого в оранжево-розовый. Опыт повторяют несколько раз, полученные результаты заносят в таблицу 4, находят средний объем соляной кислоты и рассчитывают ее молярную концентрацию эквивалента, титр и титр по определяемому веществу.
| № опыта | V Na2CO3, мл | V HCl, мл |
| Средний результат |
Vср(HCl)= 
C(HCl) =
Т(HCl) = 
Т(HCl/NaOH) = 
Источник
Работа 1. Приготовление рабочего 0,1N раствора HCl
РАСТВОРЫ
В этом разделе представлены работы, касающиеся приготовления растворов заданной концентрации и определения их свойств. Данный раздел является достаточно важным для будущих врачей, т.к. все важнейшие биологические системы (цитоплазма, кровь, лимфа, слюна, моча и т.д.) являются водными растворами солей, белков, углеводов, липидов, а также многие лекарственные средства представляют собой растворы. Работы, представленные в данном разделе, позволяют приобрести навыки приготовления растворов и их анализа.
Работа 1. Приготовление рабочего 0,1N раствора HCl
Задача работы:ознакомление с методикой определения плотности растворов и приготовление раствора методом разбавления.
Оборудование, реактивы: набор ареометров, цилиндр на 200 мл, концентрированный раствор HCl, мерная колба на 100 мл (или иного объема на усмотрение преподавателя), мерные пипетки, дистиллированная вода, груша.
Выполнение работы:
1. Чтобы приготовить приблизительно 0,1N раствор HCl путем разбавления концентрированной кислоты, необходимо знать более или менее точно концентрацию исходного концентрированного раствора соляной кислоты. Ее концентрацию можно узнать путем измерения ее плотности при помощи ареометра. Для этого наливают исследуемый раствор в цилиндр на 200 мл и опускают в него ареометр.
2. Измеряют ареометром плотность исходного раствора.
3. По справочной таблице 1.1 находят концентрацию HCl, соответствующую плотности данной соляной кислоты.
Источник
Приготовление и стандартизация рабочих растворов метода кислотно-основного титрования
Цель работы: приготовить и стандартизировать рабочие растворы метода кислотно-основного титрования – HCl и NaOH (или KOH).
Сущность работы. Для проведения титриметрического определения необходимо прежде всего приготовить стандартный (рабочий) раствор титранта.
Стандартные растворы готовят с использованием аналитических весов и точной мерной посуды (бюретки, пипетки, мерные колбы). Концентрацию их записывают с точностью до четвертой значащей цифры.
Классификация стандартных растворов и все возможные способы их приготовления представлены на схеме.
| Стандартные растворы | |||
| ¯ | ¯ | ||
| Первичные (приготовленные) | Вторичные (установленные) | ||
| ¯ | ¯ | ¯ | ¯ |
| Из стандартного исходного вещества | Из фиксанала | Из кристаллического вещества | Из более концентрированного раствора |
Первичный стандартный раствор можно приготовить сразу с точно известной концентрацией и не стандартизировать.
Способы приготовления первичных стандартных растворов:
1 .Из кристаллического стандартного вещества (установочного вещества, исходного вещества, первичного стандарта). Взвешивают на аналитических весах точную навеску стандартного вещества, переносят в мерную колбу, растворяют в дистиллированной воде, затем доводят до метки (рис. 20).
Рис. 20. Приготовление первичного стандартного раствора
из кристаллического стандартного вещества
Ориентировочную массу навески вещества для приготовления раствора рассчитывают по формуле
После взятия навески и ее растворения в мерной колбе рассчитывают точную концентрацию приготовленного раствора по формуле
Кристаллическое вещество для приготовления первичного стандартного раствора должно соответствовать ряду требований:
– состав вещества должен строго соответствовать его формуле;
– вещество должно быть устойчиво на воздухе (не должно окисляться, поглощать СО2, Н2О) при хранении в твердом состоянии и в растворе;
– вещество должно быть хорошо растворимым, нелетучим, желательно безводным;
– вещество должно быть чистым (квалификации не ниже «х. ч.» или «ч. д. а», см. &);
– вещество должно легко очищаться от примесей перекристаллизацией;
– вещество должно иметь большую молярную массу эквивалента (тогда ошибка при взятии навески будет меньше);
– вещество должно быть доступным и недорогим.
Если взять такое вещество, взвесить его на аналитических весах и растворить в мерной колбе, то получится первичный стандартный раствор.

Поскольку чаще всего в ампуле содержится 0,1 моль-экв вещества, то концентрацию стандартного раствора, приготовленного из фиксанала в мерной колбе вместимостью V, находят по формуле
Вторичный стандартный растворготовят в два этапа.
1. Готовят раствор с примерно известной концентрацией из кристаллического вещества или из более концентрированного раствора, используя технические весы и мерную посуду с ориентировочными делениями (мерные цилиндры, стаканы с делениями).
2. Определяют его точную концентрацию (стандартизируют) путем титрования первичного стандартного раствора.
В лабораторной работе рабочие растворы HCl и NaOH готовят как вторичные стандарты путем разбавления более концентрированных растворов с последующей стандартизацией по первичным стандартным растворам тетрабората натрия Na2B4O7 ∙ 10H2O и щавелевой кислоты Н2С2O4 ×2H2O. При титровании протекают следующие реакции:
(fэкв(Na2B4O7) = 
(fэкв(Н2С2O4) = 
Концентрацию растворов установочных веществ задают близкой к концентрации рабочих растворов.
Оборудование и реактивы: технические и аналитические весы, электрическая плитка, мерные цилиндры (10–25 мл, 250 мл), стаканы с делениями (500 мл), денсиметр (ареометр), склянки с этикетками для хранения рабочих растворов, мерная колба, пипетка, бюретка, колбы для титрования, тигель, Na2B4O7 ×10H2O (х. ч.), Н2С2O4 ×2H2O (х. ч.), концентрированные растворы HCl и NaOH (или KOH), индикаторы метиловый оранжевый и фенолфталеин.
Выполнение работы
1. Приготовление разбавленных растворов HCl и NaOH:
– с помощью денсиметров измеряют плотности концентрированных растворов HCl и NaOH;
– по справочнику находят их молярные концентрации (моль/л);
– рассчитывают объемы концентрированных растворов HCl и NaOH, необходимые для приготовления 500 мл (или 300 мл по указанию преподавателя) 0,1 н. растворов;
– цилиндрами отмеряют рассчитанные объемы HCl и NaOH, переносят их в стаканы вместимостью 500 мл и разбавляют дистиллированной водой до нужного объема;
– приготовленные растворы HCl и NaOH переливают в подписанные склянки для хранения, закрывают пробками и тщательно перемешивают.
Приготовленные растворы HCl и NaOH имеет приблизительно известную концентрацию, поэтому их необходимо стандартизировать.
2. Приготовление первичного стандартного раствора Na2B4O7:
– рассчитывают ориентировочную массу установочного вещества Na2B4O7 ×10H2O, необходимую для приготовления 100 мл 0,1 н. раствора;
– установочное вещество взвешивают в тигле на технических, а затем на аналитических весах;
– навеску аккуратно пересыпают через воронку в мерную колбу, тигель с оставшимися на стенках частицами Na2B4O7 ×10H2O снова взвешивают на аналитических весах;
– по разности двух взвешиваний на аналитических весах находят массу Na2B4O7 ×10H2O, перенесенного в колбу;
– смывают навеску в колбу струей горячей дистиллированной воды, заполняют колбу на 2/3 объема водой. Снимают с колбы воронку и, перемешивая содержимое колбы круговыми движениями, добиваются полного растворения Na2B4O7 ×10H2O. Затем доводят содержимое колбы до метки дистиллированной водой и тщательно перемешивают раствор, многократно переворачивая колбу;
– вычисляют молярную концентрацию эквивалента Na2B4O7 с точностью до четвертой значащей цифры и приступают к титрованию.
3. Установление точной концентрации приготовленного раствора HCl (стандартизация):
– вымытую бюретку ополаскивают небольшим количеством приготовленного рабочего раствора HCl и заполняют ее этим раствором;
– в чистую коническую колбу переносят пипеткой определенный объем (аликвоту) приготовленного раствора установочного вещества Na2B4O7, прибавляют 1–2 капли индикатора метилового оранжевого и начинают титровать, перемешивая жидкость круговым движением колбы. Титрование прекращают, как только произойдет резкое изменение окраски раствора;
– титрование повторяют несколько раз, пока не будет получено не менее трех значений объема титранта, различающихся между собой не более чем на 0,1 мл. Все полученные результаты должны обязательно заноситься в лабораторный журнал, даже если они и одинаковые.
– рассчитывают средний объем титранта, учитывая только те значения, которые различаются не более чем на 0,1 мл;
– по результатам титрования находят точную молярную концентрацию эквивалента приготовленного рабочего раствора HCl.
В некоторых случаях по указанию преподавателя рабочий раствор HCl может быть приготовлен из фиксанала или установление концентрации его может быть проведено по стандартному раствору щелочи, Na2CO3 или NaHCO3.
4. Приготовление первичного стандартного раствора Н2С2O4:
– рассчитывают ориентировочную массу установочного вещества Н2С2O4×2H2O, необходимую для приготовления 100 мл 0,1 н. раствора;
– установочное вещество взвешивают в тигле на технических, а затем на аналитических весах;
– навеску аккуратно пересыпают через воронку в мерную колбу, тигель с оставшимися на стенках частицами Н2С2O4×2H2O снова взвешивают на аналитических весах;
– по разности двух взвешиваний на аналитических весах находят массу Н2С2O4×2H2O, перенесенной в колбу;
– смывают навеску в колбу струей дистиллированной воды, заполняют колбу на 2/3 объема водой. Снимают с колбы воронку и, перемешивая содержимое колбы круговыми движениями, добиваются полного растворения Н2С2O4×2H2O. Затем доводят содержимое колбы до метки дистиллированной водой и тщательно перемешивают раствор, многократно переворачивая колбу;
– вычисляют молярную концентрацию эквивалента Н2С2O4 с точностью до четвертой значащей цифры и приступают к титрованию.
5. Установление точной концентрации приготовленного раствора NaOH (стандартизация):
– вымытую бюретку ополаскивают небольшим количеством приготовленного рабочего раствора NaOH и заполняют ее этим раствором;
– в чистую коническую колбу переносят пипеткой определенный объем (аликвоту) приготовленного раствора установочного вещества Н2С2O4, прибавляют 1–2 капли индикатора фенолфталеина и начинают титровать, перемешивая жидкость круговым движением колбы. Титрование прекращают, как только появится неисчезающая розовая окраска раствора;
– титрование повторяют несколько раз, пока не будет получено не менее трех значений объема титранта, различающихся между собой не более чем на 0,1 мл. Все полученные результаты должны обязательно заноситься в лабораторный журнал, даже если они и одинаковые;
– рассчитывают средний объем титранта, учитывая только те значения, которые различаются не более чем на 0,1 мл;
– по результатам титрования находят точную молярную концентрацию эквивалента приготовленного рабочего раствора NaOH.
В некоторых случаях по указанию преподавателя рабочий раствор NaOH может быть приготовлен из фиксанала или установление концентрации его может быть проведено по стандартному раствору HCl.
Источник