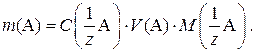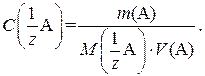- Приготовление и стандартизация рабочих растворов метода кислотно-основного титрования
- Аналитическая химия
- Работа 1. Приготовление и стандатризация раствора хлороводородной кислоты
- Работа 1. Приготовление и стандартизация раствора хлороводородной кислоты
- Оглавление
- Теоретическая часть
- Экспериментальная часть
- 1. Приготовление приблизительно 0,1 М раствора НСl
- 2. Приготовление первичного стандартного раствора 0,05 М (1/2 Na2B4O7∙10H2O)
Приготовление и стандартизация рабочих растворов метода кислотно-основного титрования
Цель работы: приготовить и стандартизировать рабочие растворы метода кислотно-основного титрования – HCl и NaOH (или KOH).
Сущность работы. Для проведения титриметрического определения необходимо прежде всего приготовить стандартный (рабочий) раствор титранта.
Стандартные растворы готовят с использованием аналитических весов и точной мерной посуды (бюретки, пипетки, мерные колбы). Концентрацию их записывают с точностью до четвертой значащей цифры.
Классификация стандартных растворов и все возможные способы их приготовления представлены на схеме.
| Стандартные растворы | |||
| ¯ | ¯ | ||
| Первичные (приготовленные) | Вторичные (установленные) | ||
| ¯ | ¯ | ¯ | ¯ |
| Из стандартного исходного вещества | Из фиксанала | Из кристаллического вещества | Из более концентрированного раствора |
Первичный стандартный раствор можно приготовить сразу с точно известной концентрацией и не стандартизировать.
Способы приготовления первичных стандартных растворов:
1 .Из кристаллического стандартного вещества (установочного вещества, исходного вещества, первичного стандарта). Взвешивают на аналитических весах точную навеску стандартного вещества, переносят в мерную колбу, растворяют в дистиллированной воде, затем доводят до метки (рис. 20).
Рис. 20. Приготовление первичного стандартного раствора
из кристаллического стандартного вещества
Ориентировочную массу навески вещества для приготовления раствора рассчитывают по формуле
После взятия навески и ее растворения в мерной колбе рассчитывают точную концентрацию приготовленного раствора по формуле
Кристаллическое вещество для приготовления первичного стандартного раствора должно соответствовать ряду требований:
– состав вещества должен строго соответствовать его формуле;
– вещество должно быть устойчиво на воздухе (не должно окисляться, поглощать СО2, Н2О) при хранении в твердом состоянии и в растворе;
– вещество должно быть хорошо растворимым, нелетучим, желательно безводным;
– вещество должно быть чистым (квалификации не ниже «х. ч.» или «ч. д. а», см. &);
– вещество должно легко очищаться от примесей перекристаллизацией;
– вещество должно иметь большую молярную массу эквивалента (тогда ошибка при взятии навески будет меньше);
– вещество должно быть доступным и недорогим.
Если взять такое вещество, взвесить его на аналитических весах и растворить в мерной колбе, то получится первичный стандартный раствор.

Поскольку чаще всего в ампуле содержится 0,1 моль-экв вещества, то концентрацию стандартного раствора, приготовленного из фиксанала в мерной колбе вместимостью V, находят по формуле
Вторичный стандартный растворготовят в два этапа.
1. Готовят раствор с примерно известной концентрацией из кристаллического вещества или из более концентрированного раствора, используя технические весы и мерную посуду с ориентировочными делениями (мерные цилиндры, стаканы с делениями).
2. Определяют его точную концентрацию (стандартизируют) путем титрования первичного стандартного раствора.
В лабораторной работе рабочие растворы HCl и NaOH готовят как вторичные стандарты путем разбавления более концентрированных растворов с последующей стандартизацией по первичным стандартным растворам тетрабората натрия Na2B4O7 ∙ 10H2O и щавелевой кислоты Н2С2O4 ×2H2O. При титровании протекают следующие реакции:
(fэкв(Na2B4O7) = 
(fэкв(Н2С2O4) = 
Концентрацию растворов установочных веществ задают близкой к концентрации рабочих растворов.
Оборудование и реактивы: технические и аналитические весы, электрическая плитка, мерные цилиндры (10–25 мл, 250 мл), стаканы с делениями (500 мл), денсиметр (ареометр), склянки с этикетками для хранения рабочих растворов, мерная колба, пипетка, бюретка, колбы для титрования, тигель, Na2B4O7 ×10H2O (х. ч.), Н2С2O4 ×2H2O (х. ч.), концентрированные растворы HCl и NaOH (или KOH), индикаторы метиловый оранжевый и фенолфталеин.
Выполнение работы
1. Приготовление разбавленных растворов HCl и NaOH:
– с помощью денсиметров измеряют плотности концентрированных растворов HCl и NaOH;
– по справочнику находят их молярные концентрации (моль/л);
– рассчитывают объемы концентрированных растворов HCl и NaOH, необходимые для приготовления 500 мл (или 300 мл по указанию преподавателя) 0,1 н. растворов;
– цилиндрами отмеряют рассчитанные объемы HCl и NaOH, переносят их в стаканы вместимостью 500 мл и разбавляют дистиллированной водой до нужного объема;
– приготовленные растворы HCl и NaOH переливают в подписанные склянки для хранения, закрывают пробками и тщательно перемешивают.
Приготовленные растворы HCl и NaOH имеет приблизительно известную концентрацию, поэтому их необходимо стандартизировать.
2. Приготовление первичного стандартного раствора Na2B4O7:
– рассчитывают ориентировочную массу установочного вещества Na2B4O7 ×10H2O, необходимую для приготовления 100 мл 0,1 н. раствора;
– установочное вещество взвешивают в тигле на технических, а затем на аналитических весах;
– навеску аккуратно пересыпают через воронку в мерную колбу, тигель с оставшимися на стенках частицами Na2B4O7 ×10H2O снова взвешивают на аналитических весах;
– по разности двух взвешиваний на аналитических весах находят массу Na2B4O7 ×10H2O, перенесенного в колбу;
– смывают навеску в колбу струей горячей дистиллированной воды, заполняют колбу на 2/3 объема водой. Снимают с колбы воронку и, перемешивая содержимое колбы круговыми движениями, добиваются полного растворения Na2B4O7 ×10H2O. Затем доводят содержимое колбы до метки дистиллированной водой и тщательно перемешивают раствор, многократно переворачивая колбу;
– вычисляют молярную концентрацию эквивалента Na2B4O7 с точностью до четвертой значащей цифры и приступают к титрованию.
3. Установление точной концентрации приготовленного раствора HCl (стандартизация):
– вымытую бюретку ополаскивают небольшим количеством приготовленного рабочего раствора HCl и заполняют ее этим раствором;
– в чистую коническую колбу переносят пипеткой определенный объем (аликвоту) приготовленного раствора установочного вещества Na2B4O7, прибавляют 1–2 капли индикатора метилового оранжевого и начинают титровать, перемешивая жидкость круговым движением колбы. Титрование прекращают, как только произойдет резкое изменение окраски раствора;
– титрование повторяют несколько раз, пока не будет получено не менее трех значений объема титранта, различающихся между собой не более чем на 0,1 мл. Все полученные результаты должны обязательно заноситься в лабораторный журнал, даже если они и одинаковые.
– рассчитывают средний объем титранта, учитывая только те значения, которые различаются не более чем на 0,1 мл;
– по результатам титрования находят точную молярную концентрацию эквивалента приготовленного рабочего раствора HCl.
В некоторых случаях по указанию преподавателя рабочий раствор HCl может быть приготовлен из фиксанала или установление концентрации его может быть проведено по стандартному раствору щелочи, Na2CO3 или NaHCO3.
4. Приготовление первичного стандартного раствора Н2С2O4:
– рассчитывают ориентировочную массу установочного вещества Н2С2O4×2H2O, необходимую для приготовления 100 мл 0,1 н. раствора;
– установочное вещество взвешивают в тигле на технических, а затем на аналитических весах;
– навеску аккуратно пересыпают через воронку в мерную колбу, тигель с оставшимися на стенках частицами Н2С2O4×2H2O снова взвешивают на аналитических весах;
– по разности двух взвешиваний на аналитических весах находят массу Н2С2O4×2H2O, перенесенной в колбу;
– смывают навеску в колбу струей дистиллированной воды, заполняют колбу на 2/3 объема водой. Снимают с колбы воронку и, перемешивая содержимое колбы круговыми движениями, добиваются полного растворения Н2С2O4×2H2O. Затем доводят содержимое колбы до метки дистиллированной водой и тщательно перемешивают раствор, многократно переворачивая колбу;
– вычисляют молярную концентрацию эквивалента Н2С2O4 с точностью до четвертой значащей цифры и приступают к титрованию.
5. Установление точной концентрации приготовленного раствора NaOH (стандартизация):
– вымытую бюретку ополаскивают небольшим количеством приготовленного рабочего раствора NaOH и заполняют ее этим раствором;
– в чистую коническую колбу переносят пипеткой определенный объем (аликвоту) приготовленного раствора установочного вещества Н2С2O4, прибавляют 1–2 капли индикатора фенолфталеина и начинают титровать, перемешивая жидкость круговым движением колбы. Титрование прекращают, как только появится неисчезающая розовая окраска раствора;
– титрование повторяют несколько раз, пока не будет получено не менее трех значений объема титранта, различающихся между собой не более чем на 0,1 мл. Все полученные результаты должны обязательно заноситься в лабораторный журнал, даже если они и одинаковые;
– рассчитывают средний объем титранта, учитывая только те значения, которые различаются не более чем на 0,1 мл;
– по результатам титрования находят точную молярную концентрацию эквивалента приготовленного рабочего раствора NaOH.
В некоторых случаях по указанию преподавателя рабочий раствор NaOH может быть приготовлен из фиксанала или установление концентрации его может быть проведено по стандартному раствору HCl.
Источник
Аналитическая химия
Работа 1. Приготовление и стандатризация раствора хлороводородной кислоты
Работа 1. Приготовление и стандартизация раствора хлороводородной кислоты
Оглавление
Теоретическая часть
Титриметрические методы основаны на точном измерении объемов растворов двух веществ, вступающих между собой в реакцию. При проведении титрования реагент, называемый титрантом, добавляют к раствору определяемого (титруемого) вещества до тех пор, пока они не провзаимодействуют в эквивалентных количествах. Методы титриметрии классифицируют по типу химической реакции, лежащей в основе определения веществ; различают методы кислотно-основного, комплексометрического, окислительно-восстановительного и осадительного титрования.
Растворы реагентов с известными концентрациями называют стандартными растворами. По способу приготовления различают первичные и вторичные стандартные растворы. Первичные стандартные растворы готовят растворением точной навески реагента и разбавлением раствора до определенного объема. Для приготовления таких растворов можно
использовать только стандартные вещества, удовлетворяющие ряду требований: они должны быть химически чистыми; устойчивыми в твердом виде и в растворе; их состав должен строго соответствовать химической формуле. Вторичные стандартные растворы получают растворением примерных навесок разных веществ, применяемых в титриметрии, а точную их концентрацию устанавливают с помощью подходящего первичного стандартного раствора. Процесс определения концентрации вторичного стандартного раствора титрованием по первичному стандартному раствору называют стандартизацией раствора.
Для проведения расчетов в титриметрии введено понятие эквивалента и фактора эквивалентности. Эквивалент – условная или реальная частица, которая может присоединять, высвобождать, замещать один ион водорода в кислотно-основных реакциях или быть эквивалентной одному электрону в окислительно-восстановительных реакциях.
Если определяемое вещество А реагирует с титрантом В по уравнению
aA + bB → продукты реакции,
то из этого уравнения следует, что одна частица вещества А эквивалентна b/a частицам вещества В. Отношение b/a — фактор эквивалентности (fэкв).
Молярной массой эквивалента вещества называют массу одного моля эквивалента этого вещества, которая равна произведению фактора эквивалентности на молярную массу вещества. Число эквивалентов веществ, вступающих в реакцию, равно n=cV·10 -3 (где с – молярная концентрация эквивалента, V – объем), поэтому для двух стехиометрически реагирующих веществ справедливо соотношение:
Следовательно, если известны молярная концентрация и объем (с1 и V1) раствора одного вещества (титранта), а также объем (V2) раствора определяемого вещества, можно определить концентрацию последнего (с2).
Молярная концентрация с – отношение числа молей растворенного вещества к объему его раствора. Например, c(1/2H2SO4) = 0,1000 M , это означает, что в 1 л растворено 4,9 г H2SO4.
Обычно при титриметрическом определении проводят несколько параллельных титрований. При этом возможны два варианта: метод пипетирования и метод отдельных навесок.
Метод пипетирования заключается в титровании равных порций раствора (аликвот Vк), отбираемых пипеткой из мерной колбы определенного объема, в котором растворена навеска анализируемого вещества.
Метод отдельных навесок заключается в том, что n навесок вещества (m1, m2 и т.д.), взятых на аналитических весах, растворяют в небольших объемах растворителя и проводят титрование в каждом растворе.
Метод пипетирования более экспрессен и менее трудоемок, но и менее точен, чем метод отдельных навесок.
Для приготовления стандартных растворов и разбавления анализируемых растворов до определенного объема служат мерные колбы объемом 25, 50, 100, 200, 250, 500 и 1000 мл. Для измерения объемов титранта используют бюретки – градуированные цилиндрические трубки с суженным концом, снабженным специальным краном. Для точного измерения определенного объема раствора и перенесения его из одного сосуда (колбы) в другой применяют пипетки.
КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ В ВОДНОМ РАСТВОРЕ
В основе метода лежит протолитическая реакция
В процессе титрования изменяется рН раствора. Конечную точку титрования устанавливают с помощью кислотно-основных индикаторов – слабых органических кислот и оснований, изменяющих свою окраску в зависимости от рН среды, поскольку их протонированные и непротонированные формы различаются по структуре и окраске. Существуют одноцветные (например, фенолфталеин) и двухцветные (метиловый оранжевый) индикаторы.
С использованием этого метода определяют кислоты, основания, азот, серу в органических соединениях и т.д.
Экспериментальная часть
Работа 1. Приготовление и стандартизация раствора хлороводородной кислоты
- Ознакомление с методом кислотно-основного титрования.
- Освоение методики приготовления и стандартизации растворов кислот и основных приемов расчетов, используемых в процессе приготовления растворов кислот заданной концентрации.
- Приобретение навыков расчетов результатов прямого титрования.
1. Приготовить приблизительно 0,1 М раствор хлороводородной кислоты.
2. Приготовить стандартный раствор тетрабората натрия.
3. Установить молярную концентрацию эквивалента соляной кислоты по тетраборату натрия.
Оборудование и реактивы:
1. Весы технические и аналитические, ареометр, штатив, бюретка; мерные цилиндры вместимостью 25 — 50 и 100 мл; колбы для титрования; мерные колбы вместимостью 500 и 200 мл; пипетка вместимостью 10 мл; воронка, стеклянный бюкс.
2. Концентрированная соляная кислота, тетраборат натрия, дистиллированная вода, индикатор метиловый оранжевый.
1. Приготовление приблизительно 0,1 М раствора НСl
Молярная масса НСl равна 36,46 г/моль. Поэтому в 500 мл 0,1 М раствора ее должно содержаться 36,46·0,1∙0,5 = 1,823 г .
Разбавленный раствор HCl готовят из концентрированного, измерив предварительно его плотность ареометром и определив по справочным таблицам массовую долю кислоты ω % в растворе. Допустим, плотность оказалась равна 1,179 г/см 3 . Кислота такой плотности имеет массовую долю HCl 36%.
Зная это, вычисляем, в какой массе концентрированной кислоты содержится нужная масса HCl:
36 г HCl содержится в 100 г кислоты
1,823 г HCl содержится в х г кислоты
х = 1,823·100/36 ≈ 5,06 г
Но взвешивать кислоту неудобно. Поэтому пересчитайте массу ее на объем:
V = m /ρ = 5,06 / 1,179 ≈ 4,3 мл
Вычисленный объем концентрированного раствора HCl отбирают мерным цилиндром, помещают в мерную колбу вместимостью 500 мл и разбавляют дистиллированной водой до метки. Полученный раствор тщательно перемешивают.
0,1 М раствор HCl можно приготовить из фиксанала.
2. Приготовление первичного стандартного раствора 0,05 М (1/2 Na2B4O7∙10H2O)
Реакция между первичным стандартом Na2B4O7∙10H2O и стандартизируемым раствором HCl протекает по уравнению:
Поскольку один моль тетрабората натрия в этой реакции взаимодействует с двумя молями ионов водорода, молярная масса эквивалента его равна:
Рассчитывают величину навески, необходимой для приготовления 0,05 М (1/2 Na2B4O7∙10H2O) в мерной колбе вместимостью 200 мл.
В бюксе на технических весах отбирают близкое к рассчитанному количество Na2B4O7∙10H2O, уточняют массу бюкса с навеской на аналитических весах. Далее осторожно пересыпают тетраборат натрия через сухую воронку в мерную колбу. Бюкс с оставшимися в нем крупинками татрабората снова точно взвешивают и по разности масс, полученных в результате первого и второго взвешивания находят массу тетрабората, насыпанного в колбу.
Струей горячей воды из промывалки хорошо смывают тетраборат натрия из воронки в колбу. Добавляют в колбу еще горячей воды, чтобы она была заполнена на 2/3 объема, вынимают воронку и перемешивают содержимое колбы до растворения тетрабората натрия. После этого раствор охлаждают до комнатной температуры и разбавляют его до метки дистиллированной водой. Под конец воду добавляют по каплям до тех пор, пока нижний край мениска не окажется на уровне метки. Приготовленный раствор тщательно перемешивают. Приготовив таким образом раствор стандартный раствор тетрабората натрия, вычисляют его молярную концентрацию:
3. Стандартизация раствора хлороводородной кислоты по тетраборату натрия
Бюретку тщательно моют и под конец ополаскивают 2 раза небольшим количеством раствора НСl, чтобы удалить из нее остатки воды. После этого бюретку наполняют почти доверху раствором НСl; затем, подставив под нее стакан, заполняют оттянутую трубку бюретки так, чтобы в ней не оставалось пузырьков воздуха. Затем уберите воронку, т.к. с нее может капать раствор, и, выпуская лишнюю кислоту, установите нижний край мениска на нулевом делении. В таком состоянии бюретка готова к работе.
Далее в три чистые конические колбы переносят тщательно вымытой пипеткой 10 мл раствора тетрабората натрия, предварительно дважды ополоснув пипетку этим же раствором. К раствору тетрабората прибавляют 1-2 капли раствора метилоранжа.
В другой такой же колбе готовят раствор «свидетель». Для этого цилиндром отмеривают 20 мл дистиллированной воды, добавляют 1 каплю метилоранжа и 1-2 капли кислоты из бюретки так, чтобы появилось слабо-розовое окрашивание раствора.
Колбу с раствором тетрабората натрия ставят под бюретку на лист белой бумаги и понемногу приливают из бюретки раствор НСl, непрерывно перемешивая жидкость плавным круговым движением колбы. Нужно уловить момент, когда от одной капли соляной кислоты первоначально чисто-желтый раствор приобретает чуть розоватый оттенок – как раз такой, как у приготовленного «свидетеля».
Добившись перемены окраски от одной капли соляной кислоты, делают отсчет по бюретке и записывают его.
При всех отсчетах необходимо, чтобы глаза наблюдателя были на уровне мениска.
Точное титрование следует повторить трижды, каждый раз беря новую порцию раствора и устанавливая уровень жидкости в бюретке на нуле. Разница в отсчетах не должна превышать 0,1 мл, если наблюдаются большие расхождения, титрование повторяют до получения трех сходящихся результатов, из которых берут среднее. Результаты записывают в таблицу.
Источник