- Универсальный индикатор как приготовить
- рН-индикаторы своими руками
- Водородный показатель рН
- Приготовление универсального индикатора для определения кислотности среды
- Дубликаты не найдены
- Лига Химиков
- Правила сообщества
- Газоразрядные грибы и овощи. )))
- Вулкан Бёттгера. Эксперимент. (запись №6)
- Хлорируем Mo, W, Al, Ga, As, Sb
- Фараоновы змеи. Эксперимент (запись №5)
- ГЕКСАХЛОРМОЛИБДАТ КАЛИЯ
- Химия Хрома, Молибдена и Вольфрама
- Немного (много) о выборе химии и химфаке
Универсальный индикатор как приготовить
Индикаторами называют вещества, служащие для определения точек эквивалентности при химических реакциях, показывающие присутствие в растворах определенного избытка отдельных ионов или веществ.
Индикаторы, применяемые в техно-химическом анализе, можно подразделить на следующие группы:
кислотно-основные, изменяющие цвет окраски, флуоресценцию или обладающие хемилюминесценцией при определенных значениях pH растворов;
адсорбционные, изменяющие цвет окраски или флуоресценцию при адсорбции на поверхности осадков;
окислительно-восстановительные, имеющие различную окраску в окисленной и восстановленной формах;
комплексометрические, изменяющие цвет окраски при образовании комплексных соединений с катионами металлов; специфические, применяемые в отдельных анализах.
Распространенными кислотно-основными индикаторами являются метиловый оранжевый, метиловый красный, конго красный, фенолфталеин.
К окислительно-восстановительным индикаторам относятся дифениламин, N-фенилантраниловая кислота.
Комплексометрическими индикаторами являются хромовый черный специальный, мурексид.
Примером адсорбционных индикаторов могут служить фуксин, флуоресцеин, применяемые в методах осаждения.
К специфическим индикаторам относится крахмал, применяемый в йодометрическом анализе.
Ниже даны рецепты приготовления растворов наиболее часто применяемых при анализе индикаторов и некоторых индикаторных бумаг.
Растворы индикаторов расходуются в сравнительно небольших количествах, поэтому в лабораториях их готовят в объеме около 100—200 мл. Обычно готовят приблизительные растворы, которые хранят в склянках из темного стекла, плотно закрываемых пробками.
Метиловый оранжевый (метилоранж, гелиантин) применяется в виде 0,1%-ного и 0,05%-ного растворов.
Для приготовления 0,1%-ного раствора 0,1 г метилового оранжевого растворяют в 80 мл горячей дистиллированной воды и после охлаждения объем раствора доводят до 100 мл.
Для приготовления 0,05%-ного раствора 50 мл 0,1%-ного раствора разбавляют 50 мл дистиллированной воды.
Раствор метилового оранжевого применяют для определения среды растворов и как индикатор в методах нейтрализации при титровании сильных кислот, сильных и слабых оснований, солей слабых кислот.
В титруемый раствор добавляют не более 1—2 капель 0,1 %-ного раствора на каждые 25 мл конечного объема титруемого раствора. Интервал перехода окраски — при рН=3,0÷4,4 от красной к оранжево-желтой. Показатель титрования рТ=4.
Метиловый красный (метилрот) применяется в виде 0,2; 0,1; 0,05%-ных растворов в 60%-ном спирте или в воде (с добавлением к воде небольшого количества щелочи).
Для приготовления 0,1%-ного спиртового раствора 0,1 г метилового красного растворяют в 60 мл 96%-ного спирта, а после растворения добавляют 40 мл дистиллированной воды.
Для приготовления 0,05%-ного водного раствора 0,1 г метилового красного растирают в фарфоровой ступке с 4 мл 0,1 н. раствора едкого натра и разбавляют дистиллированной водой до 200 мл.
Раствор метилового красного применяют в методах нейтрализации при титровании сильных кислот, сильных щелочей, а также солей слабых кислот. На титрование берут не больше 1—2 капель 0,1 %-ного раствора на 25 мл конечного объема титруемого раствора. При больших концентрациях индикатора в титруемом растворе трудно заметить переход окраски.
Интервал перехода окраски — при рН=4,2÷6,2 от красной к желтой. Показатель титрования рТ=5.
Смешанные индикаторы содержат в растворе смесь двух индикаторов, позволяющих иметь резкое изменение окраски при определенных значениях pH раствора.
Для показателя титрования 5,4 смешанный индикатор готовят путем смешивания равных объемов 0,2%-ного спиртового раствора метилового красного и 0,1%-ного спиртового раствора метилового синего. Этот смешанный индикатор применяется так же, как и раствор метилового красного. Интервал перехода окраски — при рН=5,2÷5,6 от красно-фиолетовой к зеленой.
Конго красный (копгорот) применяется в виде 0,1%-ных водных растворов.
Для приготовления раствора 0,1 г конго красного растворяют в 80 мл горячей воды и после охлаждения раствор доводят до 100 мл добавлением дистиллированной воды. Применяется для определения среды растворов. Интервал перехода окраски — при pH=3,0÷5,2 от сине-фиолетовой до красной.
Конго красную бумагу изготовляют путем пропитывания полосок фильтровальной бумаги размером 5×20 см в растворе, содержащем в 1 л 5 г конго красного и пять капель уксусной кислоты с последующей сушкой на воздухе.
Высушенную бумагу разрезают на полоски размером 0,5×5 см. Применяется для определения среды растворов.
Фенолфталеин применяется в виде 1 и 0,1%-ных спиртовых растворов.
Для приготовления 0,1%-ного спиртового раствора 0,1 г фенолфталеина растворяют в 60 мл 96%-ного спирта и доводят раствор дистиллированной водой до 100 мл.
Раствор фенолфталеина служит для определения щелочной среды растворов и как индикатор в методах нейтрализации при титровании сильных и слабых кислот, сильных щелочей и солей слабых оснований.
Интервал перехода окраски — при pH=8,2÷10,0 от бесцветной к красной. Показатель титрования рТ=9. При титровании берут две капли раствора индикатора на 25 мл конечного объема титруемого раствора.
Универсальные индикаторы служат для определения pH растворов и представляют собой смеси нескольких кислотно-основных индикаторов. В растворах, имеющих различную величину pH, эти индикаторы приобретают разную окраску.
В анализе часто пользуются универсальными индикаторными бумагами, которые выпускают заводы химических реактивов.
Дифениламин применяют в виде 0,05—1%-ного раствора в концентрированной серной кислоте. Для приготовления 0,05%-ного раствора 0,05 г дифениламина растворяют в 100 мл. химически чистой концентрированной серной кислоты. Раствор должен быть бесцветным или может иметь слабую голубую окраску.
Растворы дифениламина применяют в качестве индикаторов при титровании растворами бихромата калия, ванадата аммония, сильно разбавленным раствором перманганата калия (когда собственная окраска перманганата недостаточно заметна). На титрование берут не более двух капель 0,05%-ного раствора на 25 мл конечного объема титруемого раствора. Восстановленная форма — бесцветная, окисленная — фиолетовая. Нормальный окислительный потенциал +0,76В.
N-фенилантраниловая кислота применяется в виде 0,2%-ного раствора в воде или в виде 0,1%-ного раствора в 0,2%-ном растворе карбоната натрия.
Для приготовления 0,1%-ного раствора 0,1 г N-фенилантраниловой кислоты растворяют при нагревании в 100 мл 0,2%-ного раствора соды, который получен растворением 0,2 г соды в 100 мл дистиллированной воды.
Применяется так же, как и раствор дифениламина. Восстановленная форма бесцветная, окисленная — красно-фиолетовая.
Нормальный окислительный потенциал +1,08В.
Крахмал является специфическим индикатором на йод и применяется в виде 0,5 или 1%-ных растворов.
Для приготовления 0,5%-ного раствора 2,5 г растворимого крахмала и 0,01 г хлорида цинка или йодида ртути замешивают с небольшим количеством дистиллированной воды и полученную смесь вливают при перемешивании в 500 мл кипящей дистиллированной воды, кипятят 1—2 мин и горячий раствор фильтруют или дают ему отстояться, после чего пользуются верхней частью отстоявшегося раствора.
Перед каждой серией йодометрических анализов проверяют качество раствора, доливая к 20 мл дистиллированной воды 1 мл раствора крахмала и одну каплю раствора йода. Раствор должен получить синюю окраску; если образуется буро-фиолетовая окраска — раствор заменяют.
При титровании берут 1—2 мл раствора крахмала.
Йодкрахмальную бумагу изготовляют путем пропитывания фильтровальной бумаги в растворе, содержащем крахмал и йодистый калий.
Для получения йодкрахмальной бумаги 2 г растворимого крахмала смешивают с 10 мл дистиллированной воды до образования однородной кашицы; вносят ее в 500 мл кипящей дистиллированной воды и кипятят 1—2 мин. После охлаждения раствора к нему добавляют 2 г йодида калия. В полученном растворе смачивают полоски фильтровальной бумаги размером 5×20 см (каждую отдельно) и сушат их на воздухе, защищая от действия солнечных лучей. Высушенную бумагу разрезают на полоски 0,5х5 см и хранят в банках из темного стекла, закрытых притертыми пробками.
Йодкрахмальную бумагу применяют как индикатор на присутствие окислителей и при титровании нитритом натрия. Перед применением бумагу увлажняют.
Хромовый черный специальный (кислотный хром черный специальный, хромоген черный ЕТ-00, эриохром черный Т) и хромовый темно-синий (кислотный хром темно-синий), применяют в виде 0,5%-ных спиртовых растворов или 0,5%-ных или 1%-ных сухих смесей с электролитами.
Растворы индикаторов готовят растворением 0,5 г одного из индикаторов в 20 мл аммиачного буферного раствора, содержащего 20 г/л хлорида аммония и 100 мл/л 25%-ного аммиака водного, и разбавлением раствора до 100 мл этиловым спиртом.
Раствор хромового черного специального готовят на срок не более 10 дней, раствор хромового темно-синего сохраняется длительное время.
Сухие смеси получают путем тщательного растирания индикаторов с нитратом калия KNO3 или хлоридом натрия NaCl. Для приготовления 0,5%-ной сухой смеси 0,1 г индикатора тщательно растирают в ступке с 20 г химически чистого хлористого натрия или азотнокислого калия. Смесь хранят в закрытой банке из темного стекла с палочкой-лопаткой, вставленной в пробку.
Сухую смесь хромового черного можно хранить до 12 месяцев.
Для титрования берут 5—6 капель раствора индикатора или около 0,1 г сухой 0,5%-ной смеси. Цвет растворов этих индикаторов и их комплексных солей зависит от pH растворов, поэтому титрование ведут при строго определенных значениях pH, зависящих от индикатора и определяемых катионов. Определенные значения pH создают с помощью щелочей, кислот или буферных растворов.
Хромовый черный специальный и хромовый темно-синий применяют как индикаторы при комплексометрическом количественном определении жесткости воды, катионов кальция, магния, цинка, кадмия и др. Переход окраски от винно-красной к синей.
Мурексид (пурпуреат аммония) применяют в виде 0,3%-ного раствора или 0,2—1%-ной сухой смеси с электролитами.
Раствор мурексида готовят растворением 0,06 г мурексида в 20 мл дистиллированной воды, свободной от катионов многовалентных металлов. Раствор хранят в темной склянке не более четырех дней.
Для приготовления 1%-ной сухой смеси 0,1 г мурексида тщательно растирают в ступке с 10 г х. ч. хлористого натрия. Смесь хранят в банке из темного стекла, имеющей пробку с палочкой-лопаткой. Сухая смесь сохраняется в темном месте до шести месяцев. При титровании берут две-пять капель 0,3%-ного раствора мурексида или 10—15 мг 1%-ной сухой смеси.
Мурексид применяют при количественном комплексометрическом определении катионов кальция, меди, марганца, цинка, кобальта, никеля и других катионов. Переход окраски — от красной, оранжевой или желтой к фиолетовой. При определении различных катионов поддерживают разную величину pH среды.
Приготовление буферных растворов
Буферными растворами или буферными смесями называют растворы, способные сохранять неизменной величину pH при разбавлении или при добавлении небольших количеств кислот, щелочей, солей. Эти растворы находят применение в качестве эталонных при определении pH и для регулирования величины pH исследуемых растворов в окислительно-восстановительных методах, ком-плексометрии и др.
В качестве буферных чаще всего применяют растворы, содержащие смеси слабых кислот с их солями или смеси гидроокиси аммония (слабое основание) с ее солями. Применяются также растворы, в которых содержатся смеси сильных кислот с солями слабых кислот, или смеси щелочей с солями слабых кислот, или соли слабых кислот, а иногда и смеси сильных кислот с их солями.
Величина pH буферных растворов зависит от характера веществ, входящих в состав раствора, и их концентраций в растворе, а также в некоторой степени изменяется при изменении температуры.
Буферные растворы получают путем смешивания определенных объемов растворов отдельных веществ так, чтобы получить нужное соотношение концентраций веществ в растворе, что обеспечит необходимую величину pH.
Для приготовления буферных растворов применяют химически чистые препараты. Если буферные растворы применяются как эталоны pH, то твердые вещества для их приготовления подвергают двойной перекристаллизации, используют дистиллированную воду, не содержащую углекислого газа, с большой точностью устанавливают концентрацию растворов и точно отмеривают объемы растворов при смешивании.
Буферные растворы хранят в склянках, плотно закрытых пробками.
Состав и особенности приготовления отдельных буферных растворов описаны в справочной литературе. Приготовление буферных растворов для рН-метрии проводят, пользуясь специальными наборами фиксаналов этих растворов.
Источник
рН-индикаторы своими руками
Дома и на даче полезно иметь универсальный индикатор для определения рН-среды моющих средств, воды (питьевой, природной, аквариумной), почвы комнатных и дачных растений, при приготовлении бордосской жидкости для опрыскивания насаждений от болезней и вредителей и т.д. Для этого потребуется дополнительная информация к школьному курсу химии.
Водородный показатель рН
Показатель рН характеризует содержание в растворе ионов водорода. В воде или в любом водном растворе всегда имеется какое-то количество ионов водорода, так как молекула воды частично диссоциирует:
Значение рН — это показатель кислотности, численно равный отрицательному десятичному логарифму концентрации протонов:
рН может изменяться от 1 до 14.
рН чистой воды равен 7
Растворы с рН 7
Шкала цветовых переходов свеклы столовой
Шкала цветовых переходов чая «каркаде»
Попробуйте изготовить другие индикаторы на основе растительного сырья. Предложите способ изготовления индикаторной бумаги на основе растительных индикаторов. Фактически вы выполнили проектно-исследовательскую работу, и ее результаты можете доложить в классе и на школьной конференции.
1. Аранская О.С., Бурая И.В. Проектная деятельность школьников в процессе обучения химии: 8-11 классы: Методическое пособие. — М.: Вентана-Граф, 2007. — 288 с. — (Библиотека учителя).
2. Новошинский И.И., Новошинская Н.С.. Химия: учебник для 10 (11) класса общеобразовательных учреждений. Углубленный уровень / И.И. Новошинский, Н.С. Новошинская. — М.: ООО «Русское слово — учебник», 2014. — 440 с.: ил. — (Инновационная школа).
Автор-составитель: В.Е. Никитин, методист ГМЦ ДОгМ
Источник
Приготовление универсального индикатора для определения кислотности среды
Дубликаты не найдены
Лига Химиков
1.2K поста 10.5K подписчиков
Правила сообщества
Старайтесь выбирать качественный контент и не ставьте теги моё на копипасты
Посты с просьбой решения домашнего задания переносятся в общую ленту
1. Оскорблять пользователей.
2. Постить материал далеко не по теме и непотребный контент (в остальном грамотно используйте теги)
3. Рекламировать сомнительные сайты и услуги коммерческого характера
«Тимоловый синий, метиловый красный. » Блин, ну фенолфталеин я еще смогу достать, а все остальное — кровь девственницы и то добыть в разы проще.
Что-то для меня «универсальный индикатор» в щелочи не синий, как сказали в видео, а скорее фиолетовый
Опять проблемы цветопередачи разных экранов, как в случае с тем платьем ?
Поэтому в фотках из справочника. Цвет был дан в виде длинны волны в нанометрах.
Газоразрядные грибы и овощи. )))
Вулкан Бёттгера. Эксперимент. (запись №6)
Дихромат аммония — это соль, в состав которой входят окислитель и восстановитель. Поэтому «внутри» соли может пройти экзотермическая окислительно-восстановительная реакция.
Окислителем является хром ( VI ), который в результате реакции превращается в хром ( III ). В результате этого образуется зеленый оксид хрома.
Восстановитель — это азот, который входит в состав иона аммония. В результате реакции он превращается в газообразный азот.
(NH4)2Cr2O7 = N2 + 4H2O + Cr2 O 3
Немецким химиком Рудольфом Бёттером в 1843г. было получено оранжево-красное кристаллическое вещество — дихромат аммония (NH4)2Cr2O7.
Ученый решил провести опыты по способности вещества взрываться от удара и загораться от лучины. При ударе кристаллы дихромата аммония превратились в порошок.
После чего ученый поднес к горке порошка горящую лучину. Возгорания не произошло, но вокруг лучинки начали подпрыгивать раскаленные частицы вещества, а горка начала увеличиваться.
Также изменился ее цвет, он стал зеленым.
Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) и при взаимодействии с водой.
Металлы, стоящие в ряду правее водорода, с водными растворами кислот — неокислителей при обычных условиях не взаимодействуют.
Дихромат аммония до термической реакции (фото из интернета, не мое)
Хлорируем Mo, W, Al, Ga, As, Sb
Продолжаем серию видео, в котором смотрим на то, как на практике происходит взаимодействие хлора с разными химическими элементами. На бумаге-то оно всё хорошо. А вот на практике важны условия протекания процессов.
P.S.: в прошлых видео сжигали в хлоре галогены, щелочные металлы, золото, ртуть, уран, кремний, германий, олово, железо, медь.
P.S.2: в следующий раз будем поджигать воду во фторе.
Фараоновы змеи. Эксперимент (запись №5)
Для опыта необходимы:
1) Глюконат кальция
2) Сухое горючее
4) Негорючая поверхность
Во время нагревания глюконата кальция, происходит реакция с выделением углерода, углекислого газа, оксида кальция и воды.
С12H22CaO14 + O2 = 10C + 2CO2 ↑ + СaO + 11H2O
Из-за выделения газа и происходит «рост».
«Фараоновы змеи» довольно хрупкие, достигают в длину около 15 см.
На «змеях» присутствует белый налет — это оксид кальция, образовавшийся в результате реакции.
ГЕКСАХЛОРМОЛИБДАТ КАЛИЯ
В этом видео покажу технологию синтеза этого страшного вещества.
Надо ли вам об этом знать? – Вряд ли.
Что может быть интересно? – различные нюансы работы.
Химия Хрома, Молибдена и Вольфрама
Вот и вышла первая передача из восьми, которые мы снимаем с телеканалом «Наука»
В этот раз мы рассмотрели химию подгруппы хрома.
Вроде получилось весьма добротно.
Всем приятного просмотра!
P.S.: на моменте 22:07 есть неточность: диктор говорит «порошок Дихромата Аммония», а на самом деле там «оксид хрома». Должны были поправить, но видимо до финала правка не добралась(((
Немного (много) о выборе химии и химфаке
Полезно выбирающим жизненный путь или просто любопытствующим
Итак, всем добрый день, я химик-инженер, получивший образование по специальности в Питере, в фундаментальном вузе (и бакалавриат, и магистратура, но на разных кафедрах вышеобозначенные), тружусь по специальности не один год и успел поработать как в промышленности, так и в научной сфере и даже в преподавании: технология, катализ, радиохимия, орг.синтез, общая химия.
Химия – область крайне малопопулярная на территории бывшего СНГ, что 40 лет назад, что 20, что 10. Только сейчас начинаются хоть какие-то подвижки, благодаря популяризаторам науки, тырнетам, конторам по типу мэлсаенс.
40 лет назад все хотели быть пилотами, офицерами, актерами, певцами; 20 лет назад были пережитки 90, изменение ценностей и все хотели становиться бизнесменами, юристами и экономистами, бандитами, в десятых годах начала развиваться очень бурно и заметно IT-сфера и по сей день является одной из самых высокооплачиваемых областей (на самом деле грамотный спец в любой сфере будет получать много деняк, только нужно трудиться, развиваться, двигать головой и иметь каплю удачи – вы все это знаете из мотивационных книжек и прочей лабуды), теперь же все хотят быть блогерами и контент-мейкерами, а химия всегда была где-то на откосе жизни. Максимум – ее учили будущие доктора вместе с биологией, а людей поступающих именно на Химические факультеты было несравненно мало (пример 2010 года поступления – 1-2 тела на место на ХФ СПбГУ против 10-20 на Экономических, ВШМах, ЮрФаках, МО и прочих популярных тогда факах в том же СПбГУ).
Основная проблема – крайне скверная система образования, где преподавателей заваливают ненужными бумажками, плохо платят и не могут разработать нормальную систему обучения и подачи материала, зарываясь в бюрократические джунгли (здесь мне очень нравится политика школы Илона Маска “Ad Astra” (К звездам – лат.)).
Поэтому класса до 9 химию я ненавидел и имел стабильную 3. Когда началась органика – у меня разогрелся огромный интерес и я начал изучать ее самостоятельно, делая уклон на биологические молекулы и в особенности яды, так нелегкая привела меня на ХимФак. (прошел с 270 баллами ЕГЭ в первой же волне без вопросов, в последние года нижняя планка 271-273 – поэтому нужно потратиться на репетиторов нынешним родителям или курсам по подготовке к ЕГЭ)
Когда-то бывший специалитет (5 лет) и нынешний бакалавриат (4 года) разбивают изучение химии на взаимосвязанные логично упорядоченные части разбитые по годам:
— Сначала идет Вышмат и Общая химия и Неорганическая химия, плюсом безусловно Физика
зачем Высшая математика? – Она потребуется для изучения термодинамики, кинетики, квантовой химии. физической химии, физико-химических методов анализа и всех их возможных ответвлений, плюсом отлично развивает логику и умение абстрактно мыслить – скилл очень полезный, но многих косит из-за сухости преподавания и высокой общей сложности. В мои года длилась 2 первых курса, сейчас, кажется, ее сократили до 1 года (в программе летишь от первообразной и аналитической геометрии до диффуров и прочих страшных весчей)
зачем Общая химия? – Она напомнит химические основы, что большинству так не нравились в 7-8 классах (из-за чего многие сразу теряют нить повествования и интерес в целом). Расширит, углубит, пережует и втемяшит основы термодинамики, физики в химии, квантовой химии. Без нее дальше никуда, ибо если основа шатается – дом рухнет рано или поздно
зачем Неорганическая химия? – Она является одним из двух основных фундаментальных классов в химии в целом (органика и неорганика) – там вы будете скрупулезно разбирать каждый элемент от водорода до унуноктия-оганесона как в частности, так и разбирая общие закономерности по типу диагонального сходства, изоморфизма кристаллов (привет ХФММшники) и свойств отдельных классов элементов и классов веществ. Штука крайне интересная, многие привязываются к ней на всю дальнейшую карьеру.
Несомненный атрибут половины перваков после лабы (денатурация белка при воздействии HNO3, проходит через пару недель, по сути как термический ожог, сильно не болит)
зачем Физика? – Она нужна! Если химия – это вся материя, что нас окружает, без исключения, это буквально все, что ты видишь, ощущаешь, это ты сам (каждый раз коробит при слове “химоза” – ты и сам химоза та еще, умник!), то физика – это закономерности и правила, по которым вся материя взаимодействует. Фундаментальщина фундаментальщин! Химия и Физика под руку, в обнимку с Математикой, несущие на руках Биологию – могут объяснить вообще все. Прям все! что нас окружает (тут я задумался, а как же философия, психология, искусство, литература или то же пресловутое IT? ИХ тоже может объяснить? по-хорошему – так-то да, философия – по сути родоначальница фундаментальных наук, берущая начало в Древней Греции и Азии с Ближним Востоком; психология растет из биологии, искусство и литература из психологии и философии (ну и добавим чувство прекрасного и желание оставить след/совокупиться с объектом желания (да, секс и физиология рулит очень многим испокон веков)), а всеми любимое и популярное IT из математики и физики ( рядом стоят трясущие первыми перфокартами Бэббидж и Корсаков). Для потерявших нить повествования – все в этом мире от Искусственного интеллекта и трудяги Петровича и до химиотерапии и стразах на рожах у блогеров взаимосвязанно, и основа всего, осуществляющая эту связь – физика!
Потом по ходу дела учебы добавляются Термодинамика, как некий вводный экскурс перед ФизХимией, тепловые эффекты, энтропия и все иже с ним, будьте-здрасьте.
Со второго курса в вашу жизнь войдет (у самых умных может и раньше) – Аналитическая химия (а позже ее обязательное расширение ФХМА – физхим методы анализа) – терпеть ее не мог со страшной силой (ибо 2 курс – моя пора дикого раздолбайства) – но для многих становится выбором профессии на всю жизнь (грамотные хроматографиисты или ЯМР-щики, свободно владеющие интерпретацией двумерных COSY-NOESY спектров имеют очень вкусные оклады и интересную, но подчас сложную работу; мой первый научник к примеру сейчас большой спец по ядерному магнитному резонансу в Ливерпуле). Без аналитики – как бы ты ее не любил или боготворил – никуда. Всегда необходимо знать, что ты получил, какая концентрация целевого продукта, что за побочки, получилось ли у тебя что вообще? Не важна, наверное, только квантовикам (это отдельный класс химиков, которые на херу всех вертели – любят математику и программирование куда больше, чем химию или людей в целом).
Как свою профессию выбирает значительное количество химиков, очень востребована на рынке труда.
Спецы по ВЭЖХ — пусть скажут, в чем отличие Шимадзу от Шибари 😀
Также здесь войдет в вашу жизнь такая важная плюха как ФизХимия. Ее вообще выделяют как нечто смежное между Оргой и НеОргой, ибо нужна и тем и тем, но вполне самодостаточна как направление и может обходиться без тех и других. Штука несложная, если не спал ранее на термодинамике и общей химии с матаном, и даже очень интересная, процентов 15 – выбирают себе как дальнейшее научное направление.
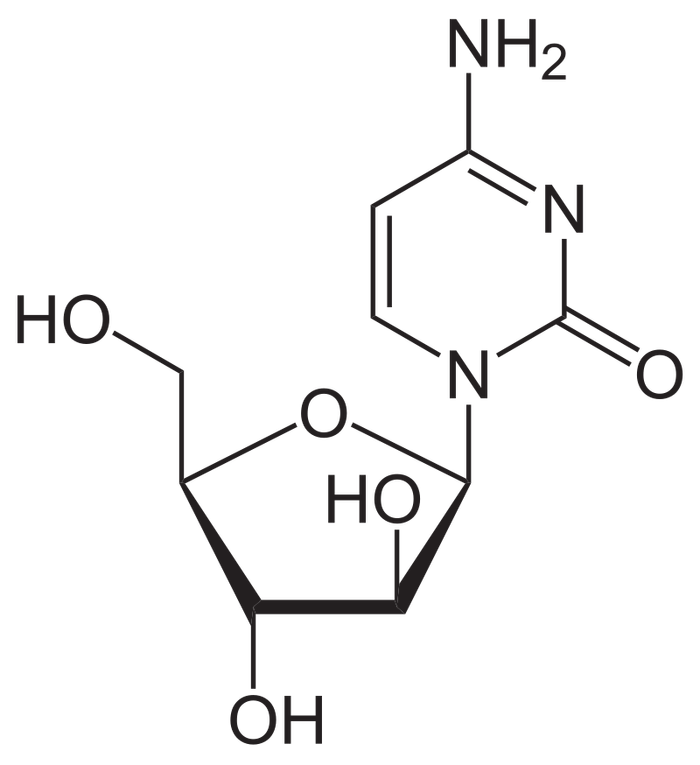
Далее 3й курс – там начинается моя ненаглядная, но очень капризная и непростая дисциплина Органическая химия. Множество классов соединений, куча правил, еще больше исключений; закономерности и их нарушения внезапные иногда могут отправлять тебя в пешее эротическое просто ПОТОМУШТА (из серии Дано___Не дано____Пойти на*уй). Но при должной любви, усердии и пролитых слезах в кружки с кофе – потихоньку отвечает взаимностью. Общее количество органических веществ на сегодняшний день свыше 27 млн, что как бы дохера. Поэтому направлений органика дает бесчисленное множество от Элементоорганической химии и до Химии высокомолекулярных соединений и Медицинской химии. Очень важна для медиков, что логично. Очень интересна при должных любви к предмету и старании.
На картинке — Цитарбин, противораковый препарат
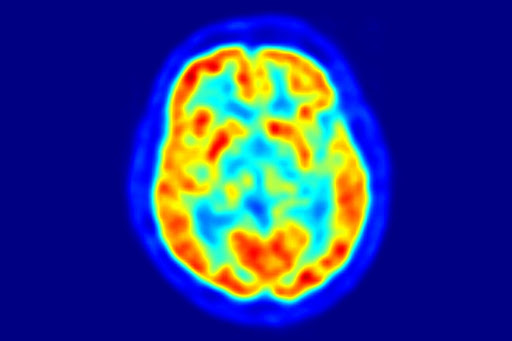
Тут же рядом на 3м курсе танцуют Квантовая Химия, Электрохимия, Коллоидная химия, что являются выходцами из Физхи, но тоже выросли в отдельные классы. Немного особняком стоит Радиохимия – это строение атома и уже больше физика, чем химия, но в целом, не столь популярна, ибо Росатом, РИ им. Хлопина захвачены бюрократами и распильщиками деняк, и двигается слабо в научном плане, но при должном старании и прозорливости можно заниматься РФП (радиофармпрепараты, ПЭТ, ОФЭКТ – загуглите, очень важно и перспективно в медицине) и уехать или поступить на PhD за бугор (бывшая однокурсница трудится в Канаде и всем очень довольна)
На фото ПЭТ-снимок головного мозга, с помощью радионуклидов исследуют динамические процессы (ни слова про шакалов)
На 4м курсе начинается большие и непростые темы, которые можно считать высшей школой высшей школы (п*зже только в маге и далее)
Это ВМС – химия высокомолекулярных соединий, полимеры и все, что с ними связано
ХОЖ – химические основы жизни – по сути медицина и молекулярная биология
ФХМА Орг и Неорг веществ – углубленные курсы аналитики в зависимости от специализации
Химическая Технология – в СПбГУ преподают на отЪ**ись, уровень куда выше в той же Техоложке
И, разумеется, на каждом курсе есть различные курсы минорные, которые ставятся обязательно (Информатика для Химиков, ПедПрактика, либо выбираются самостоятельно в зависимости от специализации (Теоретические основы ОргХимии, ЯМР, Хроматография, Твердофазный Синтез, Масс-спектрометрия, Кристаллография (обязательна для ХФММ – химия, физика и механика материалов) и т.д.)
В целом все химии между собой так или иначе взаимосвязаны и недополученные или просранные знания на 1-2 курсе рано или поздно придется возобновлять или получать заново, учась в маге, аспире или трудясь в коммерческой лабе или на производстве.
Более того в программе стоят общеобразовательные курсы, такие как История, Экономика, Безопасность труда – зачастую недолюбливается студентами за ненужностью и скучностью преподавания. Размазаны на весь период обучения.
Плюсом не забываем про курсовые работы – на 1м Курсе в области Общей химии или Неорги, на втором в области ФизХимии, на третьем – Органика, на 4м – это диплом.
Также рано или поздно придется выбрать кафедру (Неорганика, Органика, Радиоха, ФизХа, Квантовая, ФизОргХимия, Аналитика, Электроха, Колды и т.д.) – кто-то приходит на 1м курсе и работает там вплоть до аспира, кто-то меняет пару раз или даже каждый год, кто-то выбирает от безысходности в конце третьего. От лабы – вашего научника, направлении работ лабы, грантов, статей, завкафа – зависит очень многое: можно на халяву и с пользой отправить на несколько месяцев на стажировку в Португалию, ЮАР, США, Чехию и т.д., а можно сидеть и гонять чаи в лабе, распивая винище с научником, пока не опостылеет.
После окончания универа пути большинства расходятся. Дюжая часть все же поступают в магистратуру, здесь или за рубежом: кто-то по инерции, кто-то действительно горит наукой, кто-то понимает, что нахрен и уходит через полгода-год. Часть уходит после бакалавриата работать. Многие репетиторствуют с универа и продолжают после (химия, физика, математика). Кто-то вообще уходит в другую область (риэлтор, бизнесмен, блогер, финтесс-тренер, менеджер, IT-шник – разные люди были). Есть конечно и процент определенный отчислившихся (из-за лени, тупости, личных причин или других проблем) или переводившихся (у нас один парень после первого курса перешел на МатМех – сейчас юный ученый во Франции, также к нам на 1м курсе перепоступила девочка с Психологического – всякие подвижки бывают)
Программа универа от года к году незначительно меняется, могут оргу перенести на 2й курс, потом обратно, какую-то дисциплину сделать по выбору, а другую обязательной – суть от перестановки вышенаписанного шибко не меняется.
Все написанное актуально преимущественно для фундаментных вузов, в технологических ситуация немного иначе обстоит, о которой, думаю, могут рассказать мои коллеги
Тем, кто дочитал до конца – мысленное дай пять.
Могу ответить на интересующие вопросы, если есть
(спасибо, на некоторые рил интересно отвечать; плюсом исправил пару очепяток)
Источник